よむ、つかう、まなぶ。
資料2:臨床研究中核病院の承認要件見直しについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_55079.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第41回 3/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
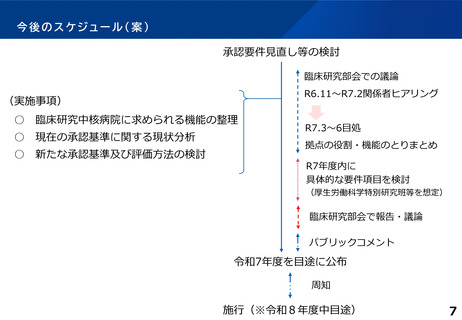
臨床研究の拠点が目指す役割や機能について
(事務局案)
現状の位置付け
○
臨床研究中核病院に対しては、これまで質の高い臨床試験の実施、人材育成、多施設支援等の役
割や機能が求められ、それに対応した承認要件を設定している。
臨床研究中核病院の役割・機能
○
日本の創薬力及び国際競争力の向上に資するため、現行の「承認要件を充足するための臨床試
験」を実施立案するのではなく、各拠点が特色を生かし、「質の高い」臨床試験を主導的に実施
し、国内での国際水準の臨床試験の中心的役割を担うこと。
○
非臨床研究中核病院や関連医療機関に対して、臨床試験の実施に関する相談、助言などの連携・
支援や人材育成を行うとともに、希少疾患等の領域において専門研究機関・研究ネットワークと
の連携等を介し、我が国全体の臨床試験の実施体制を領域横断的に底上げできること。
○
上記を達成するための十分な人員配置、構造設備等の体制を有すること。
5
(事務局案)
現状の位置付け
○
臨床研究中核病院に対しては、これまで質の高い臨床試験の実施、人材育成、多施設支援等の役
割や機能が求められ、それに対応した承認要件を設定している。
臨床研究中核病院の役割・機能
○
日本の創薬力及び国際競争力の向上に資するため、現行の「承認要件を充足するための臨床試
験」を実施立案するのではなく、各拠点が特色を生かし、「質の高い」臨床試験を主導的に実施
し、国内での国際水準の臨床試験の中心的役割を担うこと。
○
非臨床研究中核病院や関連医療機関に対して、臨床試験の実施に関する相談、助言などの連携・
支援や人材育成を行うとともに、希少疾患等の領域において専門研究機関・研究ネットワークと
の連携等を介し、我が国全体の臨床試験の実施体制を領域横断的に底上げできること。
○
上記を達成するための十分な人員配置、構造設備等の体制を有すること。
5