よむ、つかう、まなぶ。
資料2:臨床研究中核病院の承認要件見直しについて (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_55079.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第41回 3/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
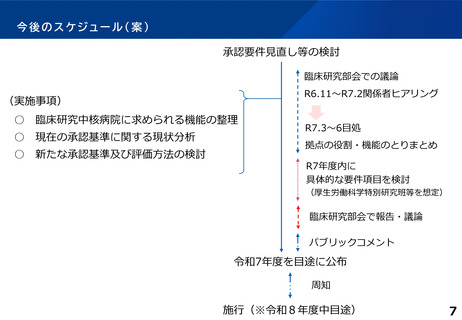
臨床研究の拠点が目指す役割や機能について
(事務局案)
目指すべき拠点のあり方(案)
1. これまでの役割や機能に加えて、臨床試験の企画立案から、その後の薬事承認・医療機器の承認
取得までの中心的な役割を担うことで「創薬」、「医療機器開発」への貢献を評価することとし、
承認要件の一部に各拠点の特色を評価できるポイント制を導入してはどうか。
2.臨床研究全体の質の確保、研究実績の継続性及び災害等の外的要因による影響の低減を図る
ために、実績の要件を評価する年数を延長することとしてはどうか。
3.承認の要件の見直しの検討に合わせて、承認の停止・取消し基準を明確化してはどうか。
例:組織的な研究不正、研究における重大な医療事故に対する不適切な対応(隠蔽、放置、虚偽
説明等)、研究関連での不正請求、悪質な虚偽の実績報告、複数年に及ぶ承認要件未達 等
4.日本起点の国際共同試験の実施(アウトバウンド)の能力を有し、領域横断的に国内の大規模
多施設共同試験を主導的に実施、かつ海外からの国際共同試験にも対応(インバウンド)
できるような中核的な役割を担う拠点として、既存の臨床研究中核病院制度の上に「国際拠点型
臨床研究中核病院」(仮称)を新たに設けることとしてはどうか。
5.特定疾患領域(小児疾患・希少疾患等)の臨床試験については、臨床研究中核病院は国立高度専門
医療研究センター(NC)と協働・連携した上で、着実に推進する体制としてはどうか。
6 .特定領域型の臨床研究中核病院の制度については、これまで活用の実績がなかったことから
廃止を含めて制度の見直しを検討してみてはどうか。
6
(事務局案)
目指すべき拠点のあり方(案)
1. これまでの役割や機能に加えて、臨床試験の企画立案から、その後の薬事承認・医療機器の承認
取得までの中心的な役割を担うことで「創薬」、「医療機器開発」への貢献を評価することとし、
承認要件の一部に各拠点の特色を評価できるポイント制を導入してはどうか。
2.臨床研究全体の質の確保、研究実績の継続性及び災害等の外的要因による影響の低減を図る
ために、実績の要件を評価する年数を延長することとしてはどうか。
3.承認の要件の見直しの検討に合わせて、承認の停止・取消し基準を明確化してはどうか。
例:組織的な研究不正、研究における重大な医療事故に対する不適切な対応(隠蔽、放置、虚偽
説明等)、研究関連での不正請求、悪質な虚偽の実績報告、複数年に及ぶ承認要件未達 等
4.日本起点の国際共同試験の実施(アウトバウンド)の能力を有し、領域横断的に国内の大規模
多施設共同試験を主導的に実施、かつ海外からの国際共同試験にも対応(インバウンド)
できるような中核的な役割を担う拠点として、既存の臨床研究中核病院制度の上に「国際拠点型
臨床研究中核病院」(仮称)を新たに設けることとしてはどうか。
5.特定疾患領域(小児疾患・希少疾患等)の臨床試験については、臨床研究中核病院は国立高度専門
医療研究センター(NC)と協働・連携した上で、着実に推進する体制としてはどうか。
6 .特定領域型の臨床研究中核病院の制度については、これまで活用の実績がなかったことから
廃止を含めて制度の見直しを検討してみてはどうか。
6