よむ、つかう、まなぶ。
資料1-2 アロチノロール塩酸塩製剤におけるN-ニトロソアロチノロールの検出及び発がんリスクに関する評価報告書[434KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_55113.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第11回 3/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
175症例)が韓国において実施され,本剤 10mg/日,20mg/日,30mg/日とpropranolol 40mg/日,80mg/
日, 160mg/日の各用量間で比較された.各用量間において本剤はpropranololと同等の振戦減少効果を
示し,motor task performance scoreの比較においてはpropranololより有意な改善が認められている7)
高血圧症、狭心症、不整脈に関連するガイドラインにおいて本剤に関する特筆すべき記載は確認
されませんでした。
5-4.措置及び供給関連
1)医療機関等への情報提供
使用期限内の全範囲(有効期間の初期、中期及び終了時)をカバーする参考品を採取し測定したとこ
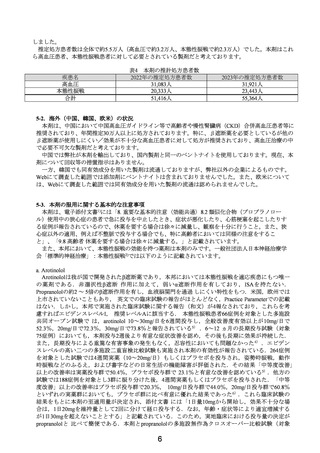
ろ、許容濃度の50ppmを超過し、4-2項にて検討しました通り、ケース3から本剤による理論上の生涯発
がんリスクは71,000人に1人と推定されました。
安全性情報データベースに登録している本剤に関する副作用等症例情報を調査した結果、本剤の服用
患者において、本件に関連すると思われる重篤な健康被害等は認められておりませんが、上述した発が
んリスクは、ICH-M7ガイドラインで許容される「おおよそ10万人に1人の増加」のリスクを上回ること
から、医療機関等へお知らせ文書にて、本剤の使用による健康影響評価の結果を情報提供します。
2)製造方法の変更等のリスク低減策
ニトロソアミン類発生の大きな要因として添加剤のうちベントナイトに含まれる亜硝酸等が特定され
ました。この添加剤のメーカーを変更し、亜硝酸等の含有が少ないものを用いることで、ニトロソアミ
ン類を許容しうる限度内に抑えることができることが分かっており、今後の製造分では許容濃度
(50ppm)を下回る製剤を出荷します。
5-3項に示す本剤の電子添付文書の記載事項、及び4-2項の理論上の発がんリスクの内容に鑑み、国内に
流通する全ての製剤がN-ニトロソアロチノロールが限度値(50ppm)を下回る製剤に入れ替わるまでの当
面の間は、本剤への患者アクセスを確保するため、当該製剤の供給を継続する必要があり、現時点におき
ましては、すでに市場に流通しているロットについては、処方の中止や変更等の措置はしないこととして
おります。ただし、4-2項に示す暫定管理値(335ppm)を設定し、それを超えるものを出荷しないよう
管理します。
3)今後の供給の見通し
今後の出荷(5mg錠:2025年1月末、10mg錠:2025年7月頃予定)からは順次許容濃度内の製剤を供給
できる見込みです。なお、5mg錠は3ロット製造し、PTP包装品のN-ニトロソアロチノロール濃度はいず
れも定量限界未満(5ppm未満)であることが確認できました。今後の製造分では許容濃度(50ppm)を
下回る製剤を出荷します。
6.
参考文献等
1) アロチノロール塩酸塩錠5mg/10mg「DSP」添付文書 2023年10月改訂(第1版)
2) 神経治療 Vol. 28 No. 3, 2011
3) 高橋 昭,松岡幸彦,山本纊子ほか:本態性振戦に対するarotinololの臨床評価―多施設共同研究,前
期第II相臨床試験―.神経治療 10 : 229-241, 1993
4) 高橋 昭,松岡幸彦,山本纊子ほか:本態性振戦に対するarotinololの長期投与試験―多施設共同研究,
第III相臨床試験―.臨床医薬 9 : 1373-1388, 1993
5) 柳澤信夫,田代邦雄,東儀英雄ほか:Arotinololの本態性振戦に対する臨床的有用性の検討.多施設
二重盲検法による第III相群間比較試験.医学のあゆみ 165 : 215-240, 1993
6) 柳澤信夫,田代邦雄,東儀英雄ほか:塩酸アロチノロールの本態性振戦に対する臨床効果の検討―
多施設二重盲検群間比較法による用量設定試験.臨床医薬 9 : 1343-1371, 1993
7) Lee KS, Kim JS, Kim JW et al : A multicenter randomized crossover multiple-dose comparison study of
arotinolol and propranolol in essential tremor. Parkinsonism Relat Disord 9 : 341-347, 2003
以上
7
日, 160mg/日の各用量間で比較された.各用量間において本剤はpropranololと同等の振戦減少効果を
示し,motor task performance scoreの比較においてはpropranololより有意な改善が認められている7)
高血圧症、狭心症、不整脈に関連するガイドラインにおいて本剤に関する特筆すべき記載は確認
されませんでした。
5-4.措置及び供給関連
1)医療機関等への情報提供
使用期限内の全範囲(有効期間の初期、中期及び終了時)をカバーする参考品を採取し測定したとこ
ろ、許容濃度の50ppmを超過し、4-2項にて検討しました通り、ケース3から本剤による理論上の生涯発
がんリスクは71,000人に1人と推定されました。
安全性情報データベースに登録している本剤に関する副作用等症例情報を調査した結果、本剤の服用
患者において、本件に関連すると思われる重篤な健康被害等は認められておりませんが、上述した発が
んリスクは、ICH-M7ガイドラインで許容される「おおよそ10万人に1人の増加」のリスクを上回ること
から、医療機関等へお知らせ文書にて、本剤の使用による健康影響評価の結果を情報提供します。
2)製造方法の変更等のリスク低減策
ニトロソアミン類発生の大きな要因として添加剤のうちベントナイトに含まれる亜硝酸等が特定され
ました。この添加剤のメーカーを変更し、亜硝酸等の含有が少ないものを用いることで、ニトロソアミ
ン類を許容しうる限度内に抑えることができることが分かっており、今後の製造分では許容濃度
(50ppm)を下回る製剤を出荷します。
5-3項に示す本剤の電子添付文書の記載事項、及び4-2項の理論上の発がんリスクの内容に鑑み、国内に
流通する全ての製剤がN-ニトロソアロチノロールが限度値(50ppm)を下回る製剤に入れ替わるまでの当
面の間は、本剤への患者アクセスを確保するため、当該製剤の供給を継続する必要があり、現時点におき
ましては、すでに市場に流通しているロットについては、処方の中止や変更等の措置はしないこととして
おります。ただし、4-2項に示す暫定管理値(335ppm)を設定し、それを超えるものを出荷しないよう
管理します。
3)今後の供給の見通し
今後の出荷(5mg錠:2025年1月末、10mg錠:2025年7月頃予定)からは順次許容濃度内の製剤を供給
できる見込みです。なお、5mg錠は3ロット製造し、PTP包装品のN-ニトロソアロチノロール濃度はいず
れも定量限界未満(5ppm未満)であることが確認できました。今後の製造分では許容濃度(50ppm)を
下回る製剤を出荷します。
6.
参考文献等
1) アロチノロール塩酸塩錠5mg/10mg「DSP」添付文書 2023年10月改訂(第1版)
2) 神経治療 Vol. 28 No. 3, 2011
3) 高橋 昭,松岡幸彦,山本纊子ほか:本態性振戦に対するarotinololの臨床評価―多施設共同研究,前
期第II相臨床試験―.神経治療 10 : 229-241, 1993
4) 高橋 昭,松岡幸彦,山本纊子ほか:本態性振戦に対するarotinololの長期投与試験―多施設共同研究,
第III相臨床試験―.臨床医薬 9 : 1373-1388, 1993
5) 柳澤信夫,田代邦雄,東儀英雄ほか:Arotinololの本態性振戦に対する臨床的有用性の検討.多施設
二重盲検法による第III相群間比較試験.医学のあゆみ 165 : 215-240, 1993
6) 柳澤信夫,田代邦雄,東儀英雄ほか:塩酸アロチノロールの本態性振戦に対する臨床効果の検討―
多施設二重盲検群間比較法による用量設定試験.臨床医薬 9 : 1343-1371, 1993
7) Lee KS, Kim JS, Kim JW et al : A multicenter randomized crossover multiple-dose comparison study of
arotinolol and propranolol in essential tremor. Parkinsonism Relat Disord 9 : 341-347, 2003
以上
7