よむ、つかう、まなぶ。
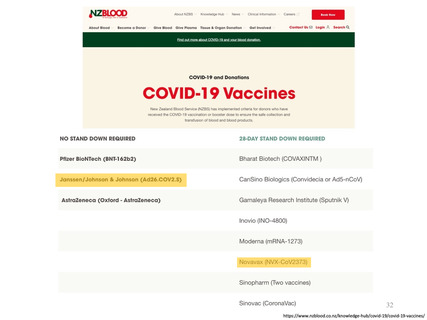
参考資料1-1 新型コロナウイルスワクチン(ノババックス、J&J)接種後の採血制限期間について(令和4年7月22日開催 大隈班会議資料) (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
FDA NEWS RELEASE
Coronavirus (COVID-19) Update: FDA Limits Use of
Janssen COVID-19 Vaccine to Certain Individuals
@ More Press AnnouncetfehRY用間【90有人7oom/press-announcements)
May 05, 2022
Espafol (/news-events/DreSS / lizacion-sobre-e[ irus-covid-19-la-fda-limita-euso-de-la-vacuna-contra-e|-covid-19-de)
Today, the U.S. Food and Drug Administration has limited the authorized use of
the Janssen COVID-19 Vaccine to individuals 18 years of age and older for whom
other authorized or approved COVID-19 vaccines are not accessible or clinically
appropriate, and to individuals 18 years of age and older who elect to receive the
Janssen COVID-1g Vaccine because they would otherwise not receive a COVID-
19 vaccine.
Key Points:
* After conducting an updated analysis, evaluation and investigation of
reported cases, the FDA has determined that the risk of thrombosis with
thrombocytopenia syndrome (TTS), a syndrome of rare and potentially life-
threatening blood clots in combination with low levels of blood platelets
with onset of symptoms approximately one to two weeks following
administration of the Janssen COVID-19 Vaccine, warrants jimiting the
authorized use of the vaccine.
* TheFDA has determined that the known and potential benefits of the
vaccine for the prevention of COVID-19 outweigh the known and potential
risks for individuals 18 years of age and older for whom other authorized or
approved COVID-19 vaccines are not accessible or clinically appropriate,
and for individuals 18 years of age and older who elect to receive the
Janssen COVID-19 Vaccine because they would otherwise not receive a
COVID-ig vaccine.
* TheF heet for H Prowi Administering Vaccine
(https://wwwr.fda.govy/media/1463o4/download) now reflects the revision
of the authorized use of the Janssen COVID-ig Vaccine and includes a
warning statement at the beginning of the fact sheet for prominence which
summarizes information on the risk for TTS. Additionally, information on
the revision to the authorized use of the vaccine and updated information
on this risk of blood clots with low levels of blood platelets has been added
to the Fact Sheet for Recipients and Caregivers
(https://www.fda.gov/media/146305/download).
Current Status
The FDA and CDC have continuously monitored for and investigated all
suspected cases of TTS reported to VAERS. In an updated analysis of TTS cases
following administraton of the Janssen COVID-19 Vaccine that were reported to
VAERS through March 18, 2o22, the FDA and CDC have identified 6o confirmed
cases, including nine fatal cases. The FDA has determined that the reporting rate
ofTTS is 3.23 per million doses of vaccine administered and the reporhng rate of
TTS deaths is Oo.48 per million doses of vaccine administered.
米FDA、J&J製コロロナワクチンの接種対象者を制限、まれ
の血栓症リスクで
(米国)
回ロロ回
ニューヨーク発
米国食品医薬局 (FDA) は5月5日、現在18歳以上であれば誰でも接種可能なジョンソン・エンド・ジョンソン (J
&J) 製の新型コロナワクチンに関し、接種対象者を制限すると発表 店 した。 今後、同社製のワクチンは、18歳以上
かつ、他社製のワクチンが入手不可能あるいは臨床上適切でないと判断され、J&J製以外のワクチンは接種しないと
いう人に限り、承認するとしている。
FDAは、接種して1一2週間後にまれに見られる、深刻な血栓症を伴う血小板減少症候群 (TTS) に関する調査の結
一人肌放認の抽還が必下だと着断した。
J&J製ワクチンは2021 年2月27日、FDAにより緊急使用許可が承認された。同年4月13日、FDAと米国疾病予防
管理センター (CDC) は、同社製ワフクチンの使用を一時停止するよう勧告する共同声明を発表した (2021年4月14
日記事参照) ものの、10日後の4月23日には同勧告を解除する共同声明を発表していた (2021年4月27日記事参
照) 人
FDAとCDCは、その後の継続調査を通じて、2022年3月18日までに9件の致命的なケースを含む合計60件のTTS
が確認されたとしている。 他方、FDAは、今回制限を受ける対象者がJ&J製のワクチン接種により受けられる利点
は、リスクに勝ると判断している。
FDA生物製剤評価研究センターのピーター・マークス所長は、発家を通じて「FDAは引き続きJ&J製を含む全ての
ワクチンの安全性を観察し、これまでどおり新たな安全性情報を徹底的に審査する」とダ述べた。
JETRO
日本質基抹王機構(ジェトロ)
24
2022年05月09日
Coronavirus (COVID-19) Update: FDA Limits Use of
Janssen COVID-19 Vaccine to Certain Individuals
@ More Press AnnouncetfehRY用間【90有人7oom/press-announcements)
May 05, 2022
Espafol (/news-events/DreSS / lizacion-sobre-e[ irus-covid-19-la-fda-limita-euso-de-la-vacuna-contra-e|-covid-19-de)
Today, the U.S. Food and Drug Administration has limited the authorized use of
the Janssen COVID-19 Vaccine to individuals 18 years of age and older for whom
other authorized or approved COVID-19 vaccines are not accessible or clinically
appropriate, and to individuals 18 years of age and older who elect to receive the
Janssen COVID-1g Vaccine because they would otherwise not receive a COVID-
19 vaccine.
Key Points:
* After conducting an updated analysis, evaluation and investigation of
reported cases, the FDA has determined that the risk of thrombosis with
thrombocytopenia syndrome (TTS), a syndrome of rare and potentially life-
threatening blood clots in combination with low levels of blood platelets
with onset of symptoms approximately one to two weeks following
administration of the Janssen COVID-19 Vaccine, warrants jimiting the
authorized use of the vaccine.
* TheFDA has determined that the known and potential benefits of the
vaccine for the prevention of COVID-19 outweigh the known and potential
risks for individuals 18 years of age and older for whom other authorized or
approved COVID-19 vaccines are not accessible or clinically appropriate,
and for individuals 18 years of age and older who elect to receive the
Janssen COVID-19 Vaccine because they would otherwise not receive a
COVID-ig vaccine.
* TheF heet for H Prowi Administering Vaccine
(https://wwwr.fda.govy/media/1463o4/download) now reflects the revision
of the authorized use of the Janssen COVID-ig Vaccine and includes a
warning statement at the beginning of the fact sheet for prominence which
summarizes information on the risk for TTS. Additionally, information on
the revision to the authorized use of the vaccine and updated information
on this risk of blood clots with low levels of blood platelets has been added
to the Fact Sheet for Recipients and Caregivers
(https://www.fda.gov/media/146305/download).
Current Status
The FDA and CDC have continuously monitored for and investigated all
suspected cases of TTS reported to VAERS. In an updated analysis of TTS cases
following administraton of the Janssen COVID-19 Vaccine that were reported to
VAERS through March 18, 2o22, the FDA and CDC have identified 6o confirmed
cases, including nine fatal cases. The FDA has determined that the reporting rate
ofTTS is 3.23 per million doses of vaccine administered and the reporhng rate of
TTS deaths is Oo.48 per million doses of vaccine administered.
米FDA、J&J製コロロナワクチンの接種対象者を制限、まれ
の血栓症リスクで
(米国)
回ロロ回
ニューヨーク発
米国食品医薬局 (FDA) は5月5日、現在18歳以上であれば誰でも接種可能なジョンソン・エンド・ジョンソン (J
&J) 製の新型コロナワクチンに関し、接種対象者を制限すると発表 店 した。 今後、同社製のワクチンは、18歳以上
かつ、他社製のワクチンが入手不可能あるいは臨床上適切でないと判断され、J&J製以外のワクチンは接種しないと
いう人に限り、承認するとしている。
FDAは、接種して1一2週間後にまれに見られる、深刻な血栓症を伴う血小板減少症候群 (TTS) に関する調査の結
一人肌放認の抽還が必下だと着断した。
J&J製ワクチンは2021 年2月27日、FDAにより緊急使用許可が承認された。同年4月13日、FDAと米国疾病予防
管理センター (CDC) は、同社製ワフクチンの使用を一時停止するよう勧告する共同声明を発表した (2021年4月14
日記事参照) ものの、10日後の4月23日には同勧告を解除する共同声明を発表していた (2021年4月27日記事参
照) 人
FDAとCDCは、その後の継続調査を通じて、2022年3月18日までに9件の致命的なケースを含む合計60件のTTS
が確認されたとしている。 他方、FDAは、今回制限を受ける対象者がJ&J製のワクチン接種により受けられる利点
は、リスクに勝ると判断している。
FDA生物製剤評価研究センターのピーター・マークス所長は、発家を通じて「FDAは引き続きJ&J製を含む全ての
ワクチンの安全性を観察し、これまでどおり新たな安全性情報を徹底的に審査する」とダ述べた。
JETRO
日本質基抹王機構(ジェトロ)
24
2022年05月09日