よむ、つかう、まなぶ。
参考資料2 新型コロナワクチンの接種について(令和4年10月7日第38回厚生科学審議会予防接種・ワクチン分科会資料1) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
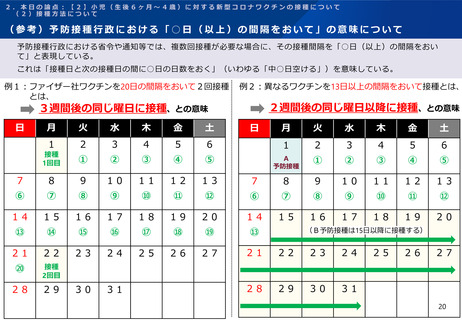
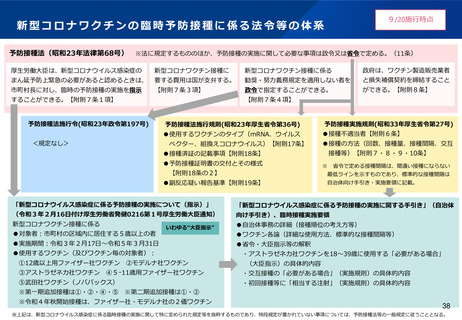
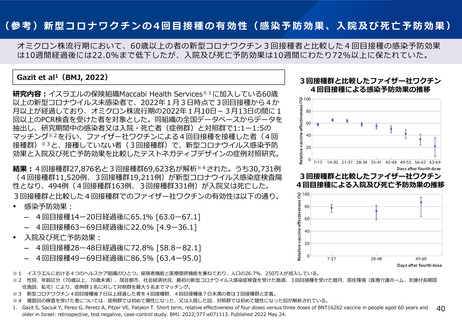
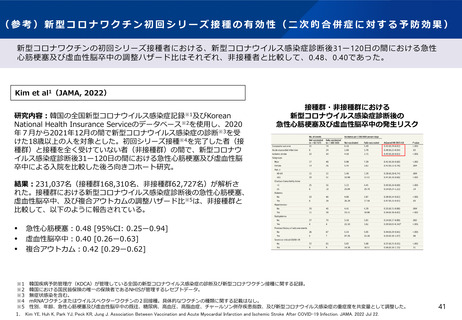
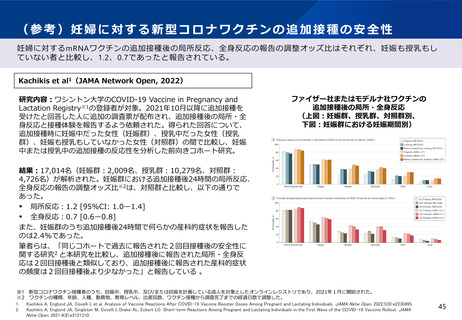
2.本日の論点:【1】小児(生後6ヶ月~4歳)に対する新型コロナワクチンの接種について
(1)有効性及び安全性について
生後6ヶ月~4歳の小児に対するファイザー社製ワクチンの有効性(審査報告書)
PMDAは、審査報告書において、生後6ヶ月~4歳の小児に対するファイザー社製ワクチンの接種(初回シリーズ:1、2及び
3回接種)について、臨床試験における免疫原性試験の結果等に基づいて、一定の有効性が期待できると判断している。
また、この臨床試験において、3回目接種後7日以降における発症予防効果は73.2%と報告されている。
ファイザー社臨床試験(PMDA提出資料)
ファイザー社の説明(抜粋・要約) :
6カ月~1歳及び2~4歳の小児のそれぞれにおける免疫原性及び安全性を
検討する海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591007試験)を実施した。
第Ⅰ相パートでは用量検討を行い、本剤の2回目接種後の安全性及び免疫
原性の結果から、いずれの年齢層においても3μgを選択した。
その後、続く第Ⅱ/Ⅲ相パートにおいて、用法・用量は治験薬(本剤3
μg 又はプラセボ)を21日間隔で2回(Day1及びDay19~23)、その
後少なくとも8週間経過した後に1回、筋肉内接種することとされた。
この結果、3回目接種1カ月後の免疫原性(表7)は、いずれの年齢層に
おいても事前に規定した基準※1が達成された。また、デルタ株及びオミ
クロン株(BA.1)に対する中和抗体価について、本剤3回目接種前と本
剤3回目接種1カ月後を比較することで評価され、いずれの年齢において
も、3回目接種により中和抗体価の上昇が示された。
有効性評価集団※2で治験薬3回目接種7日以降のCOVID-19確定例は本剤
群13例、プラセボ群21例であり、発症予防について、観察期間で調整し
たVE[両側95%CI]は73.2[43.8, 87.6]%であった。COVID-19確
定例から検出されたSARS-CoV-2は、不明1例を除きいずれもオミクロン
株※3だった※4。
PMDAの判断(抜粋・要約):
C4591007試験の第Ⅱ/Ⅲ相パートにおいて、本剤3回目接種後1カ月時点
の中和抗体価のGMR 及び抗体応答率の差について、免疫ブリッジングに
係る成功基準が達成されたこと、中和抗体価の部分集団解析でも被験者
背景による大きな差異は認められなかったこと等から、C4591001試験
で確認されているCOVID-19 発症予防効果を踏まえると、6カ月~4歳の
小児における本剤の一定の有効性は期待できると判断する。
表
有効性評価集団におけるワクチンの有効性(3回目接種後7日以降の発症予防効果)
COVID-19確定例
VE
[両側95%CI]
本剤
プラセボ
6ヶ月~4歳
本剤群:794例、プラセボ群:351例
6 カ月~1 歳
本剤群:296 例、プラセボ群:147 例
観察期間:中央値 1.9ヶ月(範囲 0.0~4.9ヶ月)
2~4 歳
本剤群:498 例、プラセボ群:204 例
観察期間:中央値 2.4か月(範囲 0.0~4.9ヶ月)
13
21
73.2%
[43.8, 87.6]
4
8
75.8%
[9.7, 94.7]
9
13
71.8%
[28.6, 89.4]
※1 中和抗体価のGMRの両側95%CIの下限値が0.67を上回り、点推定値は0.8以上、及び抗体応答率の差の両側95%CIの下限値が-10%を上回ることを基準とした。
※2 2022年6月17日時点のデータ。本剤群:794例、プラセボ群:351例。COVID-19感染歴のない集団で評価。 ※3 内訳はBA.2が27例、BA.4 が3例、BA.5 が2例及びBA.1 系統が1 例。
※4 この結果は、C4591007試験の有効性について事前に計画されていたCOVID-19 確定例が少なくとも21 例集積した時点での解析が実施され、追加で結果が報告されたもの。
12
(1)有効性及び安全性について
生後6ヶ月~4歳の小児に対するファイザー社製ワクチンの有効性(審査報告書)
PMDAは、審査報告書において、生後6ヶ月~4歳の小児に対するファイザー社製ワクチンの接種(初回シリーズ:1、2及び
3回接種)について、臨床試験における免疫原性試験の結果等に基づいて、一定の有効性が期待できると判断している。
また、この臨床試験において、3回目接種後7日以降における発症予防効果は73.2%と報告されている。
ファイザー社臨床試験(PMDA提出資料)
ファイザー社の説明(抜粋・要約) :
6カ月~1歳及び2~4歳の小児のそれぞれにおける免疫原性及び安全性を
検討する海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591007試験)を実施した。
第Ⅰ相パートでは用量検討を行い、本剤の2回目接種後の安全性及び免疫
原性の結果から、いずれの年齢層においても3μgを選択した。
その後、続く第Ⅱ/Ⅲ相パートにおいて、用法・用量は治験薬(本剤3
μg 又はプラセボ)を21日間隔で2回(Day1及びDay19~23)、その
後少なくとも8週間経過した後に1回、筋肉内接種することとされた。
この結果、3回目接種1カ月後の免疫原性(表7)は、いずれの年齢層に
おいても事前に規定した基準※1が達成された。また、デルタ株及びオミ
クロン株(BA.1)に対する中和抗体価について、本剤3回目接種前と本
剤3回目接種1カ月後を比較することで評価され、いずれの年齢において
も、3回目接種により中和抗体価の上昇が示された。
有効性評価集団※2で治験薬3回目接種7日以降のCOVID-19確定例は本剤
群13例、プラセボ群21例であり、発症予防について、観察期間で調整し
たVE[両側95%CI]は73.2[43.8, 87.6]%であった。COVID-19確
定例から検出されたSARS-CoV-2は、不明1例を除きいずれもオミクロン
株※3だった※4。
PMDAの判断(抜粋・要約):
C4591007試験の第Ⅱ/Ⅲ相パートにおいて、本剤3回目接種後1カ月時点
の中和抗体価のGMR 及び抗体応答率の差について、免疫ブリッジングに
係る成功基準が達成されたこと、中和抗体価の部分集団解析でも被験者
背景による大きな差異は認められなかったこと等から、C4591001試験
で確認されているCOVID-19 発症予防効果を踏まえると、6カ月~4歳の
小児における本剤の一定の有効性は期待できると判断する。
表
有効性評価集団におけるワクチンの有効性(3回目接種後7日以降の発症予防効果)
COVID-19確定例
VE
[両側95%CI]
本剤
プラセボ
6ヶ月~4歳
本剤群:794例、プラセボ群:351例
6 カ月~1 歳
本剤群:296 例、プラセボ群:147 例
観察期間:中央値 1.9ヶ月(範囲 0.0~4.9ヶ月)
2~4 歳
本剤群:498 例、プラセボ群:204 例
観察期間:中央値 2.4か月(範囲 0.0~4.9ヶ月)
13
21
73.2%
[43.8, 87.6]
4
8
75.8%
[9.7, 94.7]
9
13
71.8%
[28.6, 89.4]
※1 中和抗体価のGMRの両側95%CIの下限値が0.67を上回り、点推定値は0.8以上、及び抗体応答率の差の両側95%CIの下限値が-10%を上回ることを基準とした。
※2 2022年6月17日時点のデータ。本剤群:794例、プラセボ群:351例。COVID-19感染歴のない集団で評価。 ※3 内訳はBA.2が27例、BA.4 が3例、BA.5 が2例及びBA.1 系統が1 例。
※4 この結果は、C4591007試験の有効性について事前に計画されていたCOVID-19 確定例が少なくとも21 例集積した時点での解析が実施され、追加で結果が報告されたもの。
12