よむ、つかう、まなぶ。
薬-4○関係業界からの意見聴取について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
日米欧での再生医療等製品の上市・開発状況
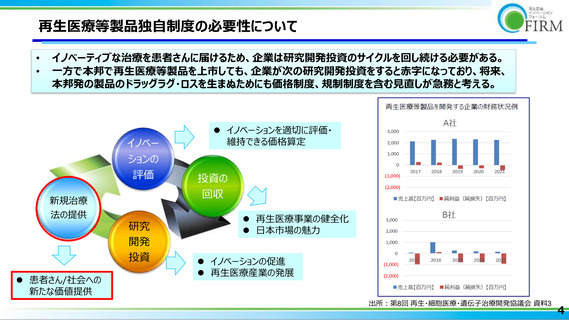
•
日米欧既承認の再生医療等製品の内、66%は本邦では開発されていない*1
•
欧米でP3実施中の再生医療等製品に関し、日本でも開発が行われているものは2割に満たない
日米欧で承認済み製品の日本での上市・開発状況
135
日本で開発されていない37品目のうち、9品目
(24%)は欧米でPriority Reviewなど薬事上の
指定*2を受けている品目であった
*2 Priority review、Fast Track、
Breakthrough Therapy、
Regenerative Medicine Advanced Therapy、
Accelerated Approval(以上US)、
Accelerated assessment、PRIME(以上EU)
17
日米欧いずれかで
上市済み
日本で上市済み
もしくは開発中
出所:Pharmaprojectsを用いてFIRM医療経済部会で作成
複数地域で開発
単独地域で開発
-85%
上市済み
P3開発中
19
2023年3月時点
パイプライン数
製品数
56
欧州はEUとUKとスイス
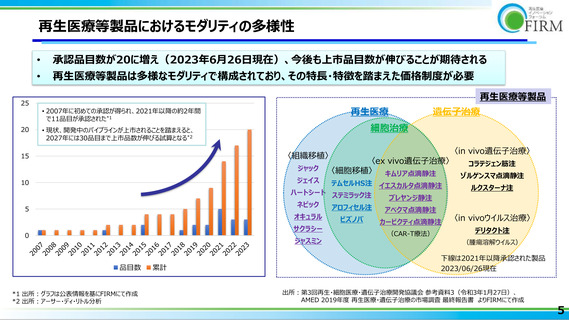
欧米でP3実施中の再生医療等製品の日本国内での開発状況
2023年2月時点
-66%
*1
77
2
58
欧米どちらかで
P3開発中
20
日本での開発あり*3
*3 Phase1~3のパイプラインまたは上市品が存在、出所:Evaluate Pharma
3
•
日米欧既承認の再生医療等製品の内、66%は本邦では開発されていない*1
•
欧米でP3実施中の再生医療等製品に関し、日本でも開発が行われているものは2割に満たない
日米欧で承認済み製品の日本での上市・開発状況
135
日本で開発されていない37品目のうち、9品目
(24%)は欧米でPriority Reviewなど薬事上の
指定*2を受けている品目であった
*2 Priority review、Fast Track、
Breakthrough Therapy、
Regenerative Medicine Advanced Therapy、
Accelerated Approval(以上US)、
Accelerated assessment、PRIME(以上EU)
17
日米欧いずれかで
上市済み
日本で上市済み
もしくは開発中
出所:Pharmaprojectsを用いてFIRM医療経済部会で作成
複数地域で開発
単独地域で開発
-85%
上市済み
P3開発中
19
2023年3月時点
パイプライン数
製品数
56
欧州はEUとUKとスイス
欧米でP3実施中の再生医療等製品の日本国内での開発状況
2023年2月時点
-66%
*1
77
2
58
欧米どちらかで
P3開発中
20
日本での開発あり*3
*3 Phase1~3のパイプラインまたは上市品が存在、出所:Evaluate Pharma
3