よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行5年後の見直しに係る検討 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24369.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第74回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
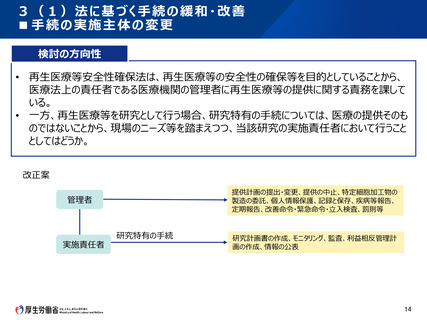
3(1)法に基づく手続の緩和・改善
・先進医療として行う場合の手続
現状
【再生医療等安全性確保法】
• 再生医療等安全性確保法の施行(平成26年11月25日)以降に、先進医療Bとして承認された再生医療等は8
件あり、うち1件が保険収載された(※1)。
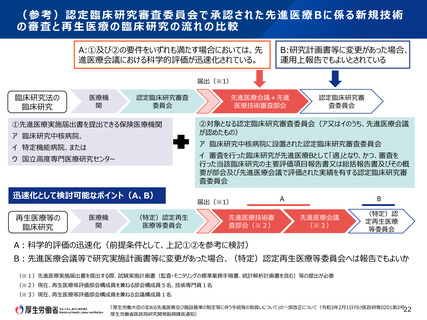
• 最先端医療迅速評価制度により、第一種再生医療等技術には迅速な審議体制が整備されている(p19,20)。
• 認定臨床研究審査委員会及び認定再生医療等委員会における研究に関する審査事項については、概ね一致して
いる(p21)。
【臨床研究法】
• 臨床研究法に基づく臨床研究については、一定の要件を満たす場合に、先進医療会議における科学的評価が迅速
化されている(p22)。
• 先進医療として実施する臨床研究において、認定臨床研究審査委員会における審査の後、先進医療技術審査部
会、先進医療会議において研究計画書等に変更があった場合、当該変更に係る認定臨床研究審査委員会の審査
意見業務については、例えば委員長のみの確認をもって行う簡便な審査を実施、事後的に認定委員会に変更内容を
報告すること(※2)として差し支えない(※3)とされている。
(※1)J003-4 多血小板血漿処置、(※2)臨床研究法施行規則第80 条第4項に基づく取扱い、(※3)臨床研究法の施行等に関するQ&A(統合
版)について(令和元年11月13日付け厚生労働省医政局研究開発振興課 事務連絡)
検討の方向性
•
•
先進医療として実施する臨床研究において、認定再生医療等委員会における審査の後、先進医療技術審査部会、
先進医療会議において研究計画書等に変更があった場合、当該変更に係る認定再生医療等委員会の審査等業務
については、事後的に認定再生医療等委員会へ報告することとしてはどうか。
なお、先進医療として臨床研究を実施する場合(一定の要件を満たした医療機関からの提出で、かつ、一定の要件
を満たした認定再生医療等委員会の審査を経た場合)における、先進医療技術審査部会及び先進医療会議の審
査過程の迅速化については、まず、先進医療技術審査部会で検討することとしてはどうか。
17
・先進医療として行う場合の手続
現状
【再生医療等安全性確保法】
• 再生医療等安全性確保法の施行(平成26年11月25日)以降に、先進医療Bとして承認された再生医療等は8
件あり、うち1件が保険収載された(※1)。
• 最先端医療迅速評価制度により、第一種再生医療等技術には迅速な審議体制が整備されている(p19,20)。
• 認定臨床研究審査委員会及び認定再生医療等委員会における研究に関する審査事項については、概ね一致して
いる(p21)。
【臨床研究法】
• 臨床研究法に基づく臨床研究については、一定の要件を満たす場合に、先進医療会議における科学的評価が迅速
化されている(p22)。
• 先進医療として実施する臨床研究において、認定臨床研究審査委員会における審査の後、先進医療技術審査部
会、先進医療会議において研究計画書等に変更があった場合、当該変更に係る認定臨床研究審査委員会の審査
意見業務については、例えば委員長のみの確認をもって行う簡便な審査を実施、事後的に認定委員会に変更内容を
報告すること(※2)として差し支えない(※3)とされている。
(※1)J003-4 多血小板血漿処置、(※2)臨床研究法施行規則第80 条第4項に基づく取扱い、(※3)臨床研究法の施行等に関するQ&A(統合
版)について(令和元年11月13日付け厚生労働省医政局研究開発振興課 事務連絡)
検討の方向性
•
•
先進医療として実施する臨床研究において、認定再生医療等委員会における審査の後、先進医療技術審査部会、
先進医療会議において研究計画書等に変更があった場合、当該変更に係る認定再生医療等委員会の審査等業務
については、事後的に認定再生医療等委員会へ報告することとしてはどうか。
なお、先進医療として臨床研究を実施する場合(一定の要件を満たした医療機関からの提出で、かつ、一定の要件
を満たした認定再生医療等委員会の審査を経た場合)における、先進医療技術審査部会及び先進医療会議の審
査過程の迅速化については、まず、先進医療技術審査部会で検討することとしてはどうか。
17