よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行5年後の見直しに係る検討 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24369.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第74回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
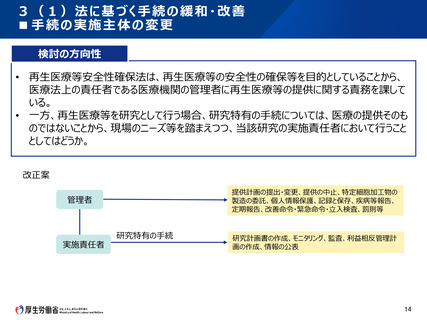
(参考) 関連法規における疾病等報告について
臨床研究法(疾病等報告)
薬機法(副作用等報告)
(認定臨床研究審査委員会への報 (治験の取扱い)
告)
第十三条 特定臨床研究実施者は、 第八十条の二
特定臨床研究の実施に起因するも 6 治験の依頼をした者又は自ら治
のと疑われる疾病、障害若しくは死
験を実施した者は、当該治験の対
亡又は感染症(次条及び第二十
象とされる薬物等その他の当該治
三条第一項において「疾病等」とい
験 に お いて 用 いる 薬物等 ( 以下
う。)の発生を知ったときは、厚生労
「治験使用薬物等」という。)につい
働省令で定めるところにより、その旨
て、当該治験使用薬物等の副作
を当該特定臨床研究の実施計画
用によるものと疑われる疾病、障害
に記載されている認定臨床研究審
又は死亡の発生、当該治験使用
査委員会に報告しなければならない。 薬物等の使用によるものと疑われる
感染症の発生その他の治験使用
(厚生労働大臣への報告)
薬物等の有効性及び安全性に関
する事項で厚生労働省令で定める
第十四条 特定臨床研究実施者は、 ものを知つたときは、その旨を厚生労
特定臨床研究の実施に起因するも
働省令で定めるところにより厚生労
のと疑われる疾病等の発生に関する
働大臣に報告しなければならない。
事項で厚生労働省令で定めるもの
この場合において、厚生労働大臣
を知ったときは、厚生労働省令で定
は、当該報告に係る情報の整理又
めるところにより、その旨を厚生労働
は当該報告に関する調査を行うも
大臣に報告しなければならない。
のとする。
再生医療法(疾病等報告)
遺伝子治療等臨床研究指針
(重篤な有害事象への対応)
(認定再生医療等委員会への疾病 (重篤な有害事象への対応)
等の報告)
第十七条 再生医療等提供機関の 第2章 第7節 第1 重篤な有害
管理者は、再生医療等提供計画 事象への対応
に記載された再生医療等の提供に 2 研究責任者の対応
起因するものと疑われる疾病、障害
⑴ 研究責任者は、遺伝子治療
若しくは死亡又は感染症の発生を
等臨床研究の実施において重
知ったときは、厚生労働省令で定め
篤な有害事象の発生を知った
るところにより、その旨を再生医療等
場合には、速やかに、その旨を
研究機関の長及び総括責任
提供計画に記載された認定再生医
者に報告するとともに、⑵の規
療等委員会に報告しなければなら
定による手順書等に従い、適
ない。
切な対応を図らなければならず、
また、当該遺伝子治療等臨床
研究の実施に携わる研究者に
(厚生労働大臣への疾病等の報
対して、速やかに当該有害事
告)
象の発生に係る情報を共有し
なければならない。この場合にお
第十八条 再生医療等提供機関の
いて、研究責任者は、当該有
管理者は、再生医療等提供計画
害事象について、倫理審査委
に記載された再生医療等の提供に
員会に意見を求め、 必要な措
起因するものと疑われる疾病、障害
置を講じるとともに、速やかに厚
若しくは死亡又は感染症の発生に
生労働大臣に報告しなければ
関する事項で厚生労働省令で定め
ならない。
るものを知ったときは、厚生労働省
令で定めるところにより、その旨を厚
生労働大臣に報告しなければなら
9
ない。
臨床研究法(疾病等報告)
薬機法(副作用等報告)
(認定臨床研究審査委員会への報 (治験の取扱い)
告)
第十三条 特定臨床研究実施者は、 第八十条の二
特定臨床研究の実施に起因するも 6 治験の依頼をした者又は自ら治
のと疑われる疾病、障害若しくは死
験を実施した者は、当該治験の対
亡又は感染症(次条及び第二十
象とされる薬物等その他の当該治
三条第一項において「疾病等」とい
験 に お いて 用 いる 薬物等 ( 以下
う。)の発生を知ったときは、厚生労
「治験使用薬物等」という。)につい
働省令で定めるところにより、その旨
て、当該治験使用薬物等の副作
を当該特定臨床研究の実施計画
用によるものと疑われる疾病、障害
に記載されている認定臨床研究審
又は死亡の発生、当該治験使用
査委員会に報告しなければならない。 薬物等の使用によるものと疑われる
感染症の発生その他の治験使用
(厚生労働大臣への報告)
薬物等の有効性及び安全性に関
する事項で厚生労働省令で定める
第十四条 特定臨床研究実施者は、 ものを知つたときは、その旨を厚生労
特定臨床研究の実施に起因するも
働省令で定めるところにより厚生労
のと疑われる疾病等の発生に関する
働大臣に報告しなければならない。
事項で厚生労働省令で定めるもの
この場合において、厚生労働大臣
を知ったときは、厚生労働省令で定
は、当該報告に係る情報の整理又
めるところにより、その旨を厚生労働
は当該報告に関する調査を行うも
大臣に報告しなければならない。
のとする。
再生医療法(疾病等報告)
遺伝子治療等臨床研究指針
(重篤な有害事象への対応)
(認定再生医療等委員会への疾病 (重篤な有害事象への対応)
等の報告)
第十七条 再生医療等提供機関の 第2章 第7節 第1 重篤な有害
管理者は、再生医療等提供計画 事象への対応
に記載された再生医療等の提供に 2 研究責任者の対応
起因するものと疑われる疾病、障害
⑴ 研究責任者は、遺伝子治療
若しくは死亡又は感染症の発生を
等臨床研究の実施において重
知ったときは、厚生労働省令で定め
篤な有害事象の発生を知った
るところにより、その旨を再生医療等
場合には、速やかに、その旨を
研究機関の長及び総括責任
提供計画に記載された認定再生医
者に報告するとともに、⑵の規
療等委員会に報告しなければなら
定による手順書等に従い、適
ない。
切な対応を図らなければならず、
また、当該遺伝子治療等臨床
研究の実施に携わる研究者に
(厚生労働大臣への疾病等の報
対して、速やかに当該有害事
告)
象の発生に係る情報を共有し
なければならない。この場合にお
第十八条 再生医療等提供機関の
いて、研究責任者は、当該有
管理者は、再生医療等提供計画
害事象について、倫理審査委
に記載された再生医療等の提供に
員会に意見を求め、 必要な措
起因するものと疑われる疾病、障害
置を講じるとともに、速やかに厚
若しくは死亡又は感染症の発生に
生労働大臣に報告しなければ
関する事項で厚生労働省令で定め
ならない。
るものを知ったときは、厚生労働省
令で定めるところにより、その旨を厚
生労働大臣に報告しなければなら
9
ない。