よむ、つかう、まなぶ。
【資料3】我が国の薬事制度に関する海外への情報発信について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
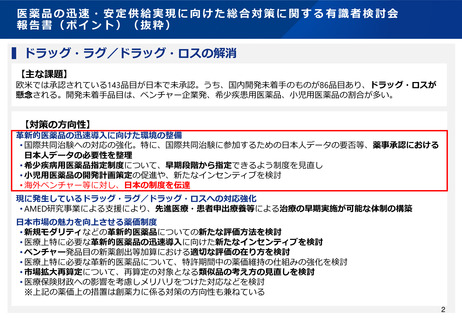
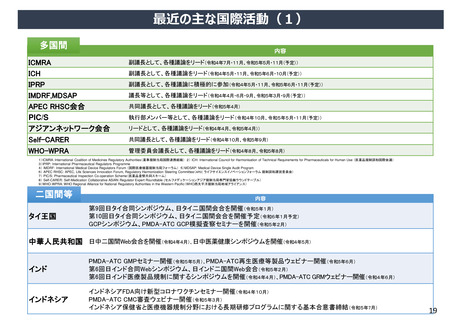
日本が参照国制度等の対象になっている主要国・地域
(令和5年8月現在)
1.医薬品
国
※括弧内は日本が対象となった年
名
制
度
2.医療機器及び体外診断用医薬品(IVD)
国
•
GMP・GLP調査結果受入れ(2002
年)
台湾
スイス
•
医薬品審査の迅速化(2010年)
タイ
•
•
医薬品審査の迅速化(2015年)
日本薬局方の参照化(2019年)
•
非臨床試験の審査結果の受入れ
(2016年)
医薬品審査の迅速化(2016年)
欧州連合
台湾
•
インド
•
名
制
度
•
医療機器及びIVDの品質管理システムに関す
る資料の軽減(2018年)
シンガポール
•
医療機器及びIVD審査の迅速化(2010年)
マレーシア
•
医療機器及びIVD審査の迅速化(2014年)
メキシコ
•
医療機器審査の迅速化(2012年)
•
•
日本の医療機器及びIVDのQMS 調査結果受入
れ(2015年)
インドでの臨床試験の実施免除(2017年)
インド
インドでの第3相試験の実施免除
(2019年)
オーストラリア
•
医療機器及びIVD審査の迅速化(2018年)
タイ
•
医療機器及びIVD審査の迅速化(2019年)
インドネシア
•
医薬品審査の迅速化(2000年)
マレーシア
•
適応追加審査の迅速化(2004年)
ベトナム
•
日本薬局方の参照化(2018年)
オーストラリア
•
医薬品審査の迅速化(2019年)
ウクライナ
•
医薬品審査の迅速化(2016年)
アラブ首長国連邦
•
医薬品審査の迅速化(2018年)
フィリピン
•
医薬品審査の迅速化(2022年)
(その他) 厚生労働省・PMDAはWHOが定義するSRA(Stringent
Regulatory Authority)(信頼できる規制当局)の1つとされている。
(その他) 日本の医療機器の承認/認証制度と同様の仕組みがWHOの
「Global model framework」 (参考にすべき規制体系)とされている。
3.医薬品簡略審査制度活用状況(ASEAN)
国
名
簡略審査制度で承認された品目数
タイ
3品目
インドネシア
1品目
フィリピン
3品目
18
(令和5年8月現在)
1.医薬品
国
※括弧内は日本が対象となった年
名
制
度
2.医療機器及び体外診断用医薬品(IVD)
国
•
GMP・GLP調査結果受入れ(2002
年)
台湾
スイス
•
医薬品審査の迅速化(2010年)
タイ
•
•
医薬品審査の迅速化(2015年)
日本薬局方の参照化(2019年)
•
非臨床試験の審査結果の受入れ
(2016年)
医薬品審査の迅速化(2016年)
欧州連合
台湾
•
インド
•
名
制
度
•
医療機器及びIVDの品質管理システムに関す
る資料の軽減(2018年)
シンガポール
•
医療機器及びIVD審査の迅速化(2010年)
マレーシア
•
医療機器及びIVD審査の迅速化(2014年)
メキシコ
•
医療機器審査の迅速化(2012年)
•
•
日本の医療機器及びIVDのQMS 調査結果受入
れ(2015年)
インドでの臨床試験の実施免除(2017年)
インド
インドでの第3相試験の実施免除
(2019年)
オーストラリア
•
医療機器及びIVD審査の迅速化(2018年)
タイ
•
医療機器及びIVD審査の迅速化(2019年)
インドネシア
•
医薬品審査の迅速化(2000年)
マレーシア
•
適応追加審査の迅速化(2004年)
ベトナム
•
日本薬局方の参照化(2018年)
オーストラリア
•
医薬品審査の迅速化(2019年)
ウクライナ
•
医薬品審査の迅速化(2016年)
アラブ首長国連邦
•
医薬品審査の迅速化(2018年)
フィリピン
•
医薬品審査の迅速化(2022年)
(その他) 厚生労働省・PMDAはWHOが定義するSRA(Stringent
Regulatory Authority)(信頼できる規制当局)の1つとされている。
(その他) 日本の医療機器の承認/認証制度と同様の仕組みがWHOの
「Global model framework」 (参考にすべき規制体系)とされている。
3.医薬品簡略審査制度活用状況(ASEAN)
国
名
簡略審査制度で承認された品目数
タイ
3品目
インドネシア
1品目
フィリピン
3品目
18