よむ、つかう、まなぶ。
【資料2】「経済財政運営と改革の基本方針2023」等関連事項について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36621.html |
| 出典情報 | 社会保障審議会医療保険部会(第171回 11/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
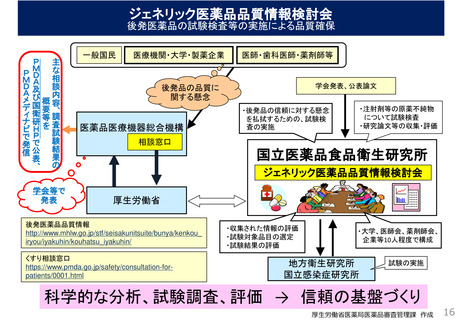
後発医薬品の品質確保等について
⚫ 後発医薬品の承認審査に当たっては、品質、有効性、安全性を
厳正に審査。
– 品質の審査
(製剤の品質:製造方法、有効成分の含有量、溶出性、不純物濃度等を比較、
確認)
– 有効性・安全性の審査
(生物学的同等性:例えばヒトでの血中濃度を比較し、同等性を確認)
⚫ 承認時に加え、承認後の製造段階においても、先発医薬品と後
発医薬品に同じ製造管理及び品質管理に係る基準(GMP)を
適用。定期的に都道府県(海外製造所はPMDA)が査察を実施。
先発医薬品と後発医薬品との間で、
品質、有効性及び安全性は同等
厚生労働省医薬局医薬品審査管理課 作成
15
⚫ 後発医薬品の承認審査に当たっては、品質、有効性、安全性を
厳正に審査。
– 品質の審査
(製剤の品質:製造方法、有効成分の含有量、溶出性、不純物濃度等を比較、
確認)
– 有効性・安全性の審査
(生物学的同等性:例えばヒトでの血中濃度を比較し、同等性を確認)
⚫ 承認時に加え、承認後の製造段階においても、先発医薬品と後
発医薬品に同じ製造管理及び品質管理に係る基準(GMP)を
適用。定期的に都道府県(海外製造所はPMDA)が査察を実施。
先発医薬品と後発医薬品との間で、
品質、有効性及び安全性は同等
厚生労働省医薬局医薬品審査管理課 作成
15