よむ、つかう、まなぶ。
【資料3-2】小児(5-11 歳)の新型コロナワクチンの接種について(健康局の説明資料) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2 . 本 日 の 論 点 : 【 1】 小 児( 5ー 11歳 ) の新 型コ ロ ナワ ク チン の接 種 につ い て
( 1 ) 小 児 ( 5- 11歳 ) の新 型コ ロ ナワ ク チン に関 す る科 学 的知 見等
第29回厚生科学審議会予防接種・ワクチン分科会
(令和4年1月26日)提出資料
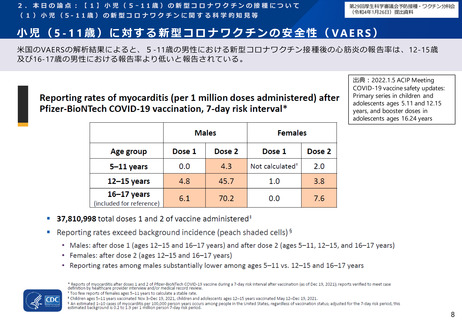
小 児 ( 5 - 1 1 歳 ) の 新型 コ ロ ナ ワク チ ン の 安全 性 ( 審査 報 告 書 )
PMDAは審査報告書において、現時点で5-11歳の小児における ファイザ ー社ワク チンにつ いて、許 容できな いリスク
を示唆する情報は得られていないと判断してい る。
ファイザー社臨床試験(PMDA提出資料)
ファイザー社の説明(抜粋・要約) :
各回接種後7日間における反応原性事象(局所反応及び全身反応):本薬群の多く
の被験者で局所反応及び全身反応が認められた。各事象の発現割合は、嘔吐、下痢
及び関節痛については本薬群とプラセボ群で同程度であったが、それ以外では本薬
群でプラセボ群よりも高かった。
有害事象:最終接種後1カ月までの有害事象(治験薬各回接種後7日間の反応原性
事象を除く)の発現割合は、本薬群10.9%(166/1,518例)、プラセボ群9.2%
(69/750例)であり、発現割合1%以上の事象は認められず、本薬群で最も発現割
合が高かった事象はリンパ節症0.9%(13/1,518例)であった。
重篤な有害事象:第Ⅱ/Ⅲ相パートの本薬群で認められた重篤な有害事象は、先行
グループ(データカットオフ日2021年9月6日)で1例(上肢骨折)、追加グルー
プ(データカットオフ日2021年10月8日)で3例(感染性関節炎、異物誤飲及び骨
端骨折各1例)に認められたが、いずれも本薬との因果関係は否定され、転帰は回
復又は軽快であった。
死亡:いずれのパートでも死亡例は認められなかった。
心筋炎・心膜炎:C4591007試験において、心筋炎又は心膜炎の発現は認められな
かった。
PMDAの判断(抜粋・要約):
被験者の多くに反応原性事象(局所反応及び全身反応)が認められたものの、ほと
んどが軽度又は中等度であり回復性が認められていること、反応原性事象以外の有
害事象の発現割合は低くほとんどは軽度又は中等度であること等を確認し、現時点
で得られている情報からは、5-11歳の小児における本薬の安全性に重大な懸念は
認められていないと判断した。
本薬接種を受けた5-11歳の小児の情報は限られているが、上述のとおり、若年層
におけるワクチン接種後の心筋炎・心膜炎の発生頻度はCOVID-19に合併する心筋
炎関連事象の発生頻度よりも低く、発現したとしてもほとんどが無症状又は軽症で
あることや、年齢層別の発生状況を踏まえると、現時点で5-11歳の小児において
許容できないリスクを示唆する情報は得られていない。
4
( 1 ) 小 児 ( 5- 11歳 ) の新 型コ ロ ナワ ク チン に関 す る科 学 的知 見等
第29回厚生科学審議会予防接種・ワクチン分科会
(令和4年1月26日)提出資料
小 児 ( 5 - 1 1 歳 ) の 新型 コ ロ ナ ワク チ ン の 安全 性 ( 審査 報 告 書 )
PMDAは審査報告書において、現時点で5-11歳の小児における ファイザ ー社ワク チンにつ いて、許 容できな いリスク
を示唆する情報は得られていないと判断してい る。
ファイザー社臨床試験(PMDA提出資料)
ファイザー社の説明(抜粋・要約) :
各回接種後7日間における反応原性事象(局所反応及び全身反応):本薬群の多く
の被験者で局所反応及び全身反応が認められた。各事象の発現割合は、嘔吐、下痢
及び関節痛については本薬群とプラセボ群で同程度であったが、それ以外では本薬
群でプラセボ群よりも高かった。
有害事象:最終接種後1カ月までの有害事象(治験薬各回接種後7日間の反応原性
事象を除く)の発現割合は、本薬群10.9%(166/1,518例)、プラセボ群9.2%
(69/750例)であり、発現割合1%以上の事象は認められず、本薬群で最も発現割
合が高かった事象はリンパ節症0.9%(13/1,518例)であった。
重篤な有害事象:第Ⅱ/Ⅲ相パートの本薬群で認められた重篤な有害事象は、先行
グループ(データカットオフ日2021年9月6日)で1例(上肢骨折)、追加グルー
プ(データカットオフ日2021年10月8日)で3例(感染性関節炎、異物誤飲及び骨
端骨折各1例)に認められたが、いずれも本薬との因果関係は否定され、転帰は回
復又は軽快であった。
死亡:いずれのパートでも死亡例は認められなかった。
心筋炎・心膜炎:C4591007試験において、心筋炎又は心膜炎の発現は認められな
かった。
PMDAの判断(抜粋・要約):
被験者の多くに反応原性事象(局所反応及び全身反応)が認められたものの、ほと
んどが軽度又は中等度であり回復性が認められていること、反応原性事象以外の有
害事象の発現割合は低くほとんどは軽度又は中等度であること等を確認し、現時点
で得られている情報からは、5-11歳の小児における本薬の安全性に重大な懸念は
認められていないと判断した。
本薬接種を受けた5-11歳の小児の情報は限られているが、上述のとおり、若年層
におけるワクチン接種後の心筋炎・心膜炎の発生頻度はCOVID-19に合併する心筋
炎関連事象の発生頻度よりも低く、発現したとしてもほとんどが無症状又は軽症で
あることや、年齢層別の発生状況を踏まえると、現時点で5-11歳の小児において
許容できないリスクを示唆する情報は得られていない。
4
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。