よむ、つかう、まなぶ。
再生医療等製品不具合報告 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00016.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和5年度第2回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和6年3月7日
令和5年度第2回医療機器・再生医療等製品
安全対策部会
資料2-3-1
再生医療等製品不具合報告
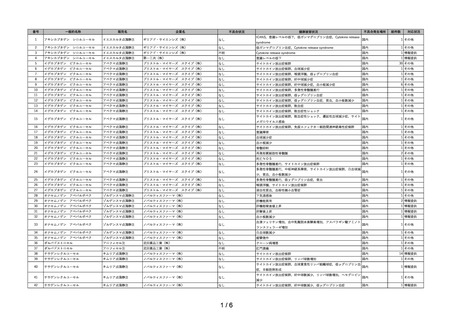
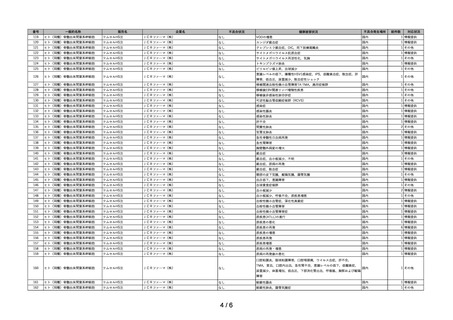
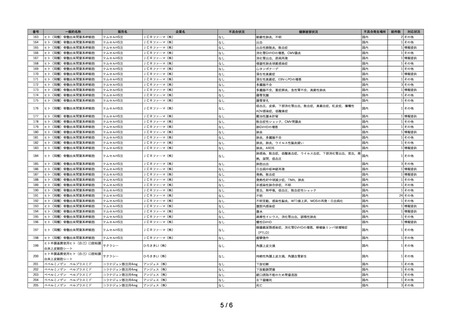
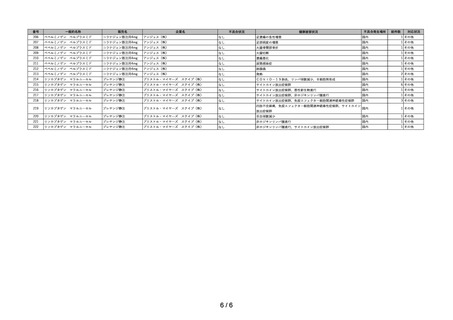
~再生医療等製品不具合等報告の集計結果についての注意事項~
1)再生医療等製品不具合・感染症報告については、再生医療等製品との因果関係が不明なものを含め製造販売業者等及び医薬関係者から報告されたものであ
り、再生医療等製品との関連性が必ずしも明確になったものばかりではない。
2)不具合等報告の件数については、提出された報告書の件数を示したものであり、同一の症例に複数の製品が関与している場合、当該症例が複数の企業から
それぞれ報告されることもある。このような場合、同一症例を重複してカウントするようになることから、ここに示された報告件数がそのまま症例数には
ならない場合がある。
3)
「対応状況」欄の記載については、原則、令和5年9月 30 日時点における措置の内容を簡潔に示したものである。主な記載事項及び内容は次のとおり。
・
「情報提供」
: 添付文書の改訂又は情報提供が行われたもの(当該報告が添付文書改訂の契機となった場合のほか、既に添付文書等で関連する情報
提供が行われている場合を含む。)
・
「その他」
: その他の事項
令和5年度第2回医療機器・再生医療等製品
安全対策部会
資料2-3-1
再生医療等製品不具合報告
~再生医療等製品不具合等報告の集計結果についての注意事項~
1)再生医療等製品不具合・感染症報告については、再生医療等製品との因果関係が不明なものを含め製造販売業者等及び医薬関係者から報告されたものであ
り、再生医療等製品との関連性が必ずしも明確になったものばかりではない。
2)不具合等報告の件数については、提出された報告書の件数を示したものであり、同一の症例に複数の製品が関与している場合、当該症例が複数の企業から
それぞれ報告されることもある。このような場合、同一症例を重複してカウントするようになることから、ここに示された報告件数がそのまま症例数には
ならない場合がある。
3)
「対応状況」欄の記載については、原則、令和5年9月 30 日時点における措置の内容を簡潔に示したものである。主な記載事項及び内容は次のとおり。
・
「情報提供」
: 添付文書の改訂又は情報提供が行われたもの(当該報告が添付文書改訂の契機となった場合のほか、既に添付文書等で関連する情報
提供が行われている場合を含む。)
・
「その他」
: その他の事項