よむ、つかう、まなぶ。
04 資料1-2 帯状疱疹ワクチンについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40826.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第26回 6/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
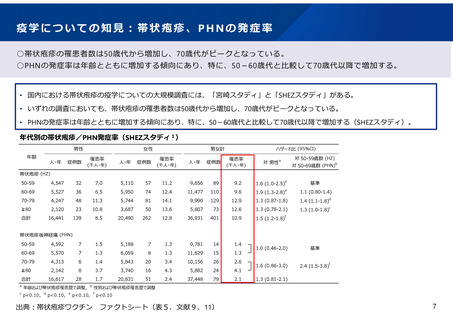
組換えワクチンの安全性についての知見
○組換えワクチンの安全性について、国内臨床試験において確認されている。
• 70歳以上を対象とした組換え帯状疱疹ワクチンの第Ⅲ相無作為化プラセボ対照比較試験の日本人集団のサブ解析において、
ワクチン群で最も頻度の高い局所性特定有害事象は注射部位疼痛(89.2%)、全身性特定有害事象は倦怠感(5.4%)だった。副
反応は年齢にかかわらず一過性だった。
ワクチン接種後 4.2年間の追跡期間中、重篤な有害事象はワクチン群の15.1%、プラセボ群の13.4%で生じ、免疫介在疾患は ワ
クチン群の1.7%,プラセボ群の2.2%で発症し、両群で同程度であった。
治験責任者によりワクチンと関連ありと判断された重篤な有害事象、ワクチンと関連ありと判断された死亡例はなかった。
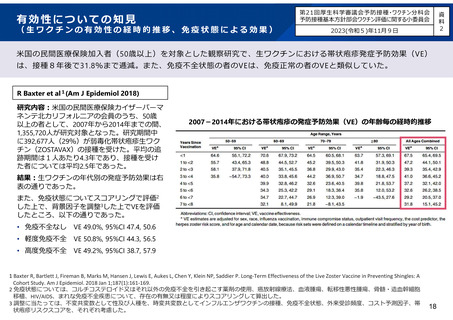
プラセボ群とワクチン群における有害事象(国内臨床試験)
有害事象
安全性評価サブグループ
(接種7日以内)
接種部位の反応
疼痛
全ての有害事象
Grade3の有害事象†
発赤
全ての有害事象
Grade3の有害事象†
腫脹
全ての有害事象
Grade3の有害事象†
全身反応
倦怠感
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
消化器障害
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
ワクチン群(N=186)
症例数/合計
%(95% CI)
プラセボ群(N=187)
症例数/合計 %(95% CI)
166
7
89.2 (83.9-93.3)
3.8 (1.5-7.6)
31 16.6 (11.6-22.7)
0
0.0 (0.0-2.0)
140
34
75.3 (68.4-81.3)
18.3 (13.0-24.6)
10
0
5.3 (2.6-9.6)
0.0 (0.0-2.0)
120
14
64.5 (57.2-71.4)
7.5 (4.2-12.3)
5
0
2.7 (0.9-6.1)
0.0 (0.0-2.0)
100
10
93
53.8 (46.3-61.1)
5.4 (2.6-9.7)
50.0 (42.6-57.4)
23
0
19
12.3 (8.0-17.9)
0.0 (0.0-2.0)
10.2 (6.2-15.4)
40
2
34
21.5 (15.8-28.1)
1.1 (0.1-3.8)
18.3 (13.0-24.6)
13
0
5
7.0 (3.8-11.6)
0.0 (0.0-2.0)
2.7 (0.9-6.1)
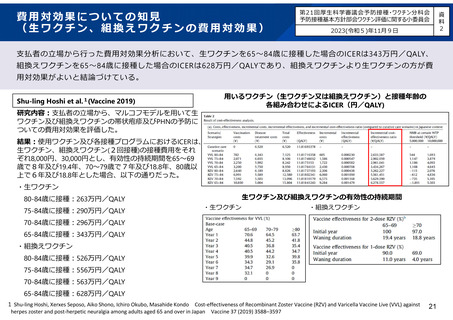
有害事象
頭痛
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
筋肉痛
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
悪寒
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
発熱
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
ワクチン群(N=186)
症例数/合計
%(95% CI)
出典:帯状疱疹ワクチン
プラセボ群(N=187)
症例数/合計 %(95% CI)
82
4
77
44.1 (36.8-51.5)
2.2 (0.6-5.4)
41.4 (34.2-48.8)
15
0
9
8.0 (4.8-12.9)
0.0 (0.0-2.0)
4.8 (2.2-8.9)
109
6
100
58.6 (51.2-65.8)
3.2 (1.2-6.9)
53.8 (46.3-61.1)
23
0
17
12.3 (8.0-17.9)
0.0 (0.0-2.0)
9.1 (5.4-14.2)
63
7
59
33.9 (27.1-41.2)
3.8 (1.5-7.6)
31.7 (25.1-38.9)
6
0
3
3.2 (1.2-6.9)
0.0 (0.0-2.0)
1.6 (0.3-4.6)
47
0
45
25.3 (19.2-32.1)
0.0 (0.0-2.0)
24.2 (18.2-31.0)
3
0
2
1.6 (0.3-4.6)
0.0 (0.0-2.0)
1.1 (0.1-3.8)
ファクトシート(表15、文献147)
9
○組換えワクチンの安全性について、国内臨床試験において確認されている。
• 70歳以上を対象とした組換え帯状疱疹ワクチンの第Ⅲ相無作為化プラセボ対照比較試験の日本人集団のサブ解析において、
ワクチン群で最も頻度の高い局所性特定有害事象は注射部位疼痛(89.2%)、全身性特定有害事象は倦怠感(5.4%)だった。副
反応は年齢にかかわらず一過性だった。
ワクチン接種後 4.2年間の追跡期間中、重篤な有害事象はワクチン群の15.1%、プラセボ群の13.4%で生じ、免疫介在疾患は ワ
クチン群の1.7%,プラセボ群の2.2%で発症し、両群で同程度であった。
治験責任者によりワクチンと関連ありと判断された重篤な有害事象、ワクチンと関連ありと判断された死亡例はなかった。
プラセボ群とワクチン群における有害事象(国内臨床試験)
有害事象
安全性評価サブグループ
(接種7日以内)
接種部位の反応
疼痛
全ての有害事象
Grade3の有害事象†
発赤
全ての有害事象
Grade3の有害事象†
腫脹
全ての有害事象
Grade3の有害事象†
全身反応
倦怠感
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
消化器障害
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
ワクチン群(N=186)
症例数/合計
%(95% CI)
プラセボ群(N=187)
症例数/合計 %(95% CI)
166
7
89.2 (83.9-93.3)
3.8 (1.5-7.6)
31 16.6 (11.6-22.7)
0
0.0 (0.0-2.0)
140
34
75.3 (68.4-81.3)
18.3 (13.0-24.6)
10
0
5.3 (2.6-9.6)
0.0 (0.0-2.0)
120
14
64.5 (57.2-71.4)
7.5 (4.2-12.3)
5
0
2.7 (0.9-6.1)
0.0 (0.0-2.0)
100
10
93
53.8 (46.3-61.1)
5.4 (2.6-9.7)
50.0 (42.6-57.4)
23
0
19
12.3 (8.0-17.9)
0.0 (0.0-2.0)
10.2 (6.2-15.4)
40
2
34
21.5 (15.8-28.1)
1.1 (0.1-3.8)
18.3 (13.0-24.6)
13
0
5
7.0 (3.8-11.6)
0.0 (0.0-2.0)
2.7 (0.9-6.1)
有害事象
頭痛
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
筋肉痛
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
悪寒
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
発熱
全ての有害事象
Grade3の有害事象†
ワクチンに関連あり
ワクチン群(N=186)
症例数/合計
%(95% CI)
出典:帯状疱疹ワクチン
プラセボ群(N=187)
症例数/合計 %(95% CI)
82
4
77
44.1 (36.8-51.5)
2.2 (0.6-5.4)
41.4 (34.2-48.8)
15
0
9
8.0 (4.8-12.9)
0.0 (0.0-2.0)
4.8 (2.2-8.9)
109
6
100
58.6 (51.2-65.8)
3.2 (1.2-6.9)
53.8 (46.3-61.1)
23
0
17
12.3 (8.0-17.9)
0.0 (0.0-2.0)
9.1 (5.4-14.2)
63
7
59
33.9 (27.1-41.2)
3.8 (1.5-7.6)
31.7 (25.1-38.9)
6
0
3
3.2 (1.2-6.9)
0.0 (0.0-2.0)
1.6 (0.3-4.6)
47
0
45
25.3 (19.2-32.1)
0.0 (0.0-2.0)
24.2 (18.2-31.0)
3
0
2
1.6 (0.3-4.6)
0.0 (0.0-2.0)
1.1 (0.1-3.8)
ファクトシート(表15、文献147)
9