よむ、つかう、まなぶ。
資料3:臨床研究中核病院の承認要件に係る取扱いについて (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別紙)
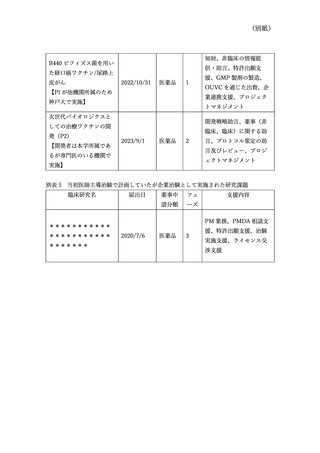
7)診療科別の臨床研究に関する意見交換
当院では、各診療科の臨床研究マネージャーが参加する臨床研究マネージャー会議や、す
べての研究者が参加可能である臨床研究意見交換会を実施してきたが、特に若手の研究者
は、当院が行っている研究支援体制を十分理解していないことが分かった。そこで、診療科
別に臨床研究に関する意見交換の場をもつこととする。その場では、臨床研究の資金獲得を
含む支援体制を説明し、現場から研究支援に関する要望を吸い上げる。そのことで、臨床研
究実施の敷居を下げ、研究推進につなげる。
以上1)~7)の対策により、今後も継続的に臨床研究の推進を図っていくこととしている。
11
7)診療科別の臨床研究に関する意見交換
当院では、各診療科の臨床研究マネージャーが参加する臨床研究マネージャー会議や、す
べての研究者が参加可能である臨床研究意見交換会を実施してきたが、特に若手の研究者
は、当院が行っている研究支援体制を十分理解していないことが分かった。そこで、診療科
別に臨床研究に関する意見交換の場をもつこととする。その場では、臨床研究の資金獲得を
含む支援体制を説明し、現場から研究支援に関する要望を吸い上げる。そのことで、臨床研
究実施の敷居を下げ、研究推進につなげる。
以上1)~7)の対策により、今後も継続的に臨床研究の推進を図っていくこととしている。
11