よむ、つかう、まなぶ。
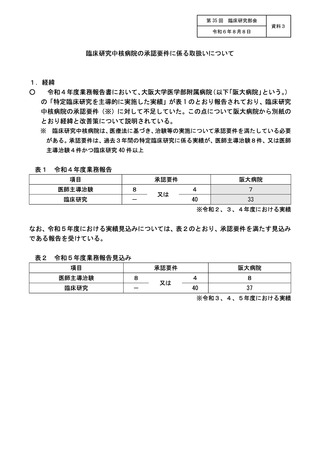
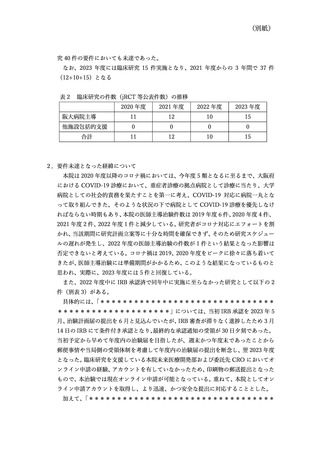
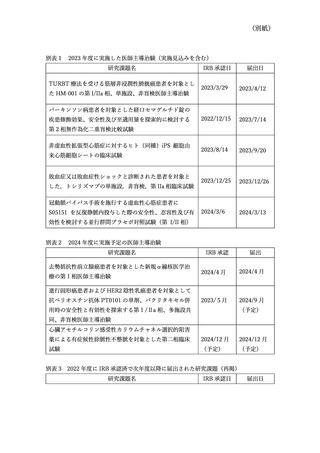
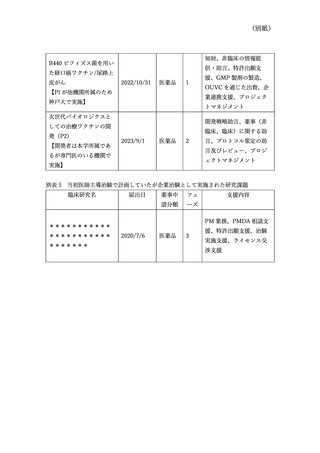
資料3:臨床研究中核病院の承認要件に係る取扱いについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別紙)
書式を、2020 年以降に他施設も参照できるように次々公開した。このことで、企業からの
研究資金を獲得しやすい環境整備はすすんできていると考えている。
②阪大病院データバンク
阪大病院データバンクは、本院で発生する医療情報を医療機器・治療法の開発のために集
積し、産官学で利用することを患者同意のもとで進めるプロジェクトである。既に 13,000
人を超える患者から同意を取得しており、現在企業とその活用について協議中である。今後
こうした枠組みの中から、産学共同の臨床試験の発案がなされることが期待されている。
3)分散型臨床試験(Decentralized Clinical Trial(DCT)
)への積極的対応
本院では、2022 年グローバルベンダーである*******社と秘密保持契約締結し、
さらに訪問看護事業サービスベンダーと秘密保持契約締結した。2023 年には、製薬企業 2
社と DCT の実施可能性に関する協議を開始し、DCT の理解促進目的に、当院主催の DCT
セミナーを開催してきた(計 3 回、参加申し込み者数 2000 名以上)
。そして、本院感染制
御部により、宿泊療養所を利用した DCT(特定臨床研究)実施に至っている。2023 年 10
月にDCT/DX 推進グループを新たに創設し大規模臨床試験(特定臨床研究)を準備中であ
る。このように新たな臨床試験の枠組みに即座に対応できる人員を確保し対応することで、
産学共同の臨床試験およびアカデミア発の臨床試験の推進に繋がるものと確信している。
4)橋渡し研究の推進
本学は文科省/AMED 橋渡し研究プログラムの拠点として、その第1期から基盤整備を進
め 2022 年からは大臣認定の橋渡し研究機関としてシーズ開発支援を積極的に行ってきた。
医師主導治験や再生医療等の臨床研究の実施も積極的に取り組んでおり、学内・外のシーズ
あわせると 2018 年度は 6 件(本学5)、2019 年度は 7 件(本学 6)
、2020 年度は 4 件(本
学 2)の医師主導治験の治験届を行っている。COVID-19 パンデミックの影響を受けて、
2021 年度、2022 年度はそれぞれ 1 件(本学 1)
、2 件(本学 0)のみとなったが、2023 年
度には回復が見られ、2023 年 12 月 31 日現在で 3 件(本学 2)
、さらに 1 件(本学1)の治
験届を目指して支援中である。2024 年度に医師主導治験届の達成を目指すシーズは、現時
点で上記のほかに 2 件(本学 2)あることから、COVID-19 影響下に一時的に医師主導治
験の推進活動が停滞したが、今後は従前のごとく高い活動性を保てると考えている。
しかしながら、より一層の橋渡し研究推進を目指すために、以下のような対策を講じており、
その結果が、今後実ってくると期待される。
①シーズ発掘の強化:AMED 橋渡し研究プログラム異分野融合研究支援推進事業や再生・
細胞医療・遺伝子治療実現加速化プログラム(事業化戦略支援)の獲得、JST 共創の場「フ
ォトニクス生命工学研究開発拠点」
、AMED ワクチン拠点など異分野融合大型プロジェクト
への参入
②TPP コンサルテーション:早期シーズ、異分野シーズに対して TPP コンサルテーション
を実施し、特に異分野研究者や基礎研究者にとって困難な、開発品の臨床的位置づけや開発
方向性、最適なモダリティ、投与方法などを開発早期から明確化することに努めている。こ
9
書式を、2020 年以降に他施設も参照できるように次々公開した。このことで、企業からの
研究資金を獲得しやすい環境整備はすすんできていると考えている。
②阪大病院データバンク
阪大病院データバンクは、本院で発生する医療情報を医療機器・治療法の開発のために集
積し、産官学で利用することを患者同意のもとで進めるプロジェクトである。既に 13,000
人を超える患者から同意を取得しており、現在企業とその活用について協議中である。今後
こうした枠組みの中から、産学共同の臨床試験の発案がなされることが期待されている。
3)分散型臨床試験(Decentralized Clinical Trial(DCT)
)への積極的対応
本院では、2022 年グローバルベンダーである*******社と秘密保持契約締結し、
さらに訪問看護事業サービスベンダーと秘密保持契約締結した。2023 年には、製薬企業 2
社と DCT の実施可能性に関する協議を開始し、DCT の理解促進目的に、当院主催の DCT
セミナーを開催してきた(計 3 回、参加申し込み者数 2000 名以上)
。そして、本院感染制
御部により、宿泊療養所を利用した DCT(特定臨床研究)実施に至っている。2023 年 10
月にDCT/DX 推進グループを新たに創設し大規模臨床試験(特定臨床研究)を準備中であ
る。このように新たな臨床試験の枠組みに即座に対応できる人員を確保し対応することで、
産学共同の臨床試験およびアカデミア発の臨床試験の推進に繋がるものと確信している。
4)橋渡し研究の推進
本学は文科省/AMED 橋渡し研究プログラムの拠点として、その第1期から基盤整備を進
め 2022 年からは大臣認定の橋渡し研究機関としてシーズ開発支援を積極的に行ってきた。
医師主導治験や再生医療等の臨床研究の実施も積極的に取り組んでおり、学内・外のシーズ
あわせると 2018 年度は 6 件(本学5)、2019 年度は 7 件(本学 6)
、2020 年度は 4 件(本
学 2)の医師主導治験の治験届を行っている。COVID-19 パンデミックの影響を受けて、
2021 年度、2022 年度はそれぞれ 1 件(本学 1)
、2 件(本学 0)のみとなったが、2023 年
度には回復が見られ、2023 年 12 月 31 日現在で 3 件(本学 2)
、さらに 1 件(本学1)の治
験届を目指して支援中である。2024 年度に医師主導治験届の達成を目指すシーズは、現時
点で上記のほかに 2 件(本学 2)あることから、COVID-19 影響下に一時的に医師主導治
験の推進活動が停滞したが、今後は従前のごとく高い活動性を保てると考えている。
しかしながら、より一層の橋渡し研究推進を目指すために、以下のような対策を講じており、
その結果が、今後実ってくると期待される。
①シーズ発掘の強化:AMED 橋渡し研究プログラム異分野融合研究支援推進事業や再生・
細胞医療・遺伝子治療実現加速化プログラム(事業化戦略支援)の獲得、JST 共創の場「フ
ォトニクス生命工学研究開発拠点」
、AMED ワクチン拠点など異分野融合大型プロジェクト
への参入
②TPP コンサルテーション:早期シーズ、異分野シーズに対して TPP コンサルテーション
を実施し、特に異分野研究者や基礎研究者にとって困難な、開発品の臨床的位置づけや開発
方向性、最適なモダリティ、投与方法などを開発早期から明確化することに努めている。こ
9