よむ、つかう、まなぶ。
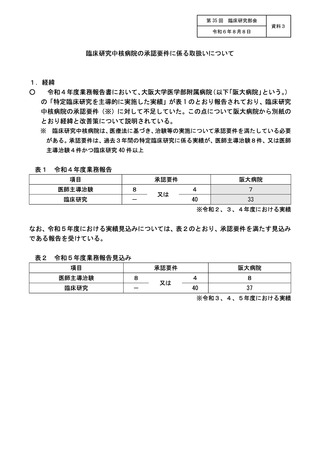
資料3:臨床研究中核病院の承認要件に係る取扱いについて (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別紙)
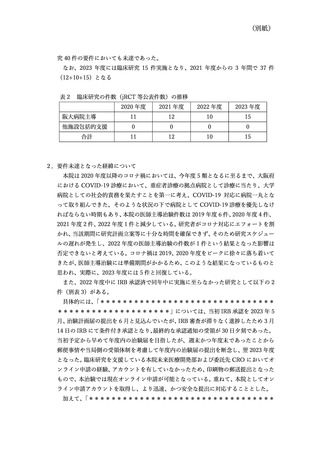
******************」については、2022 年 12 月に IRB 承認され、
2022 年度中に治験届を提出する予定であったところ、当該治験に使用する薬剤の治験
薬提供者である企業からの治験薬提供が大幅に遅れ、2023 年 8 月の輸入となったこと
を受け、スケジュール全体が 10 か月程度遅延することとなり、翌年度 2023 年 7 月 12
日の治験届提出となった。これは、当該企業の global 審査が当初提示されていた予定
よりも大幅に遅延したことが要因で、コロナ禍ということもあり、プロセスに時間を要
してしまったことも一因であると考えている。この遅延について当該企業の日本法人
の方へ問い合わせていたが、企業側の決裁や会議体を経た検討ということのみで、詳細
は不明であった。
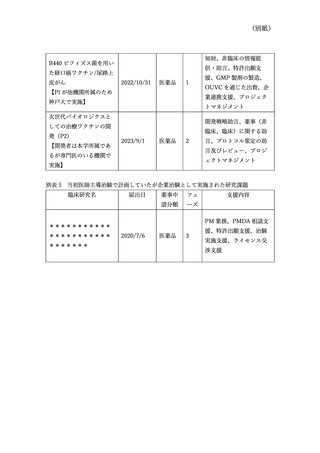
さらに、本院は文部科学省の橋渡し拠点として学内、学外のシーズ支援を行っている
が、当初は学内拠点シーズであったものが、研究責任者の他機関への異動等により異動
先機関を中心に実施することとなった医師主導治験が 2020 年度から 2022 年度の間に
5 件(別表 4)あったこと、支援の結果、企業治験での実施となったものが 1 件(別表
5)あったことも要件未達の要因と考えている。
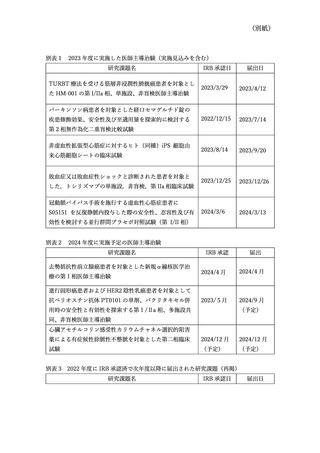
3.改善のための対策について
1)病院臨床研究支援
本院では、2018 年の臨床研究法の施行以降、臨床研究の件数が減っていることに対し
病院として危機感を持ち、病院執行部にて臨床研究支援のための対策を検討し、2021 年
度から特定臨床研究の実施に関する研究、もしくは医師主導治験の立案に関し、当院の臨
床研究支援組織である未来医療開発部による支援を 3 年間提供する事業を開始し、毎年
公募を 2 回実施している。公募により採択された研究に対し、各年度開始分に対して総
額 2,000 万円/年(最大 3 年度分 6,000 万円)の予算を確保し、AMED に応募し採択さ
れなかった研究などを支援することで本院の臨床研究の裾野を広げ、臨床研究活動の促
進を図っている。2021 年度 4 件、2022 年度 4 件、2023 年度 4 件の合計 12 件の特定臨床
研究(うち、1 件は医師主導治験を計画するものであったが、治験薬提供の見込みがなく
なったため、特定臨床研究として計画することに変更)を採択し、プロトコールライティ
ング、データマネジメント、監査業務等の支援を行っており、次年度以降も継続して支援
を行う予定である。
2)産学連携体制の強化
①企業からの臨床研究資金の獲得推進
臨床研究法において、企業から研究資金の提供を受けることは、臨床研究推進には不可欠
であるが、契約書の内容の調整に時間を要したり、企業側が消極的になったりするなど課題
があった。そこで、医薬品企業法務研究会(医法研)が日本製薬医学会(JAPhMed)と共同
で作成し公開している契約書のサンプル書式を参考に、本学の実情に沿った契約書式とし
て一部改変し、共同臨床研究契約書(企業発案型)や研究者主導臨床研究書等 5 種類の契約
8
******************」については、2022 年 12 月に IRB 承認され、
2022 年度中に治験届を提出する予定であったところ、当該治験に使用する薬剤の治験
薬提供者である企業からの治験薬提供が大幅に遅れ、2023 年 8 月の輸入となったこと
を受け、スケジュール全体が 10 か月程度遅延することとなり、翌年度 2023 年 7 月 12
日の治験届提出となった。これは、当該企業の global 審査が当初提示されていた予定
よりも大幅に遅延したことが要因で、コロナ禍ということもあり、プロセスに時間を要
してしまったことも一因であると考えている。この遅延について当該企業の日本法人
の方へ問い合わせていたが、企業側の決裁や会議体を経た検討ということのみで、詳細
は不明であった。
さらに、本院は文部科学省の橋渡し拠点として学内、学外のシーズ支援を行っている
が、当初は学内拠点シーズであったものが、研究責任者の他機関への異動等により異動
先機関を中心に実施することとなった医師主導治験が 2020 年度から 2022 年度の間に
5 件(別表 4)あったこと、支援の結果、企業治験での実施となったものが 1 件(別表
5)あったことも要件未達の要因と考えている。
3.改善のための対策について
1)病院臨床研究支援
本院では、2018 年の臨床研究法の施行以降、臨床研究の件数が減っていることに対し
病院として危機感を持ち、病院執行部にて臨床研究支援のための対策を検討し、2021 年
度から特定臨床研究の実施に関する研究、もしくは医師主導治験の立案に関し、当院の臨
床研究支援組織である未来医療開発部による支援を 3 年間提供する事業を開始し、毎年
公募を 2 回実施している。公募により採択された研究に対し、各年度開始分に対して総
額 2,000 万円/年(最大 3 年度分 6,000 万円)の予算を確保し、AMED に応募し採択さ
れなかった研究などを支援することで本院の臨床研究の裾野を広げ、臨床研究活動の促
進を図っている。2021 年度 4 件、2022 年度 4 件、2023 年度 4 件の合計 12 件の特定臨床
研究(うち、1 件は医師主導治験を計画するものであったが、治験薬提供の見込みがなく
なったため、特定臨床研究として計画することに変更)を採択し、プロトコールライティ
ング、データマネジメント、監査業務等の支援を行っており、次年度以降も継続して支援
を行う予定である。
2)産学連携体制の強化
①企業からの臨床研究資金の獲得推進
臨床研究法において、企業から研究資金の提供を受けることは、臨床研究推進には不可欠
であるが、契約書の内容の調整に時間を要したり、企業側が消極的になったりするなど課題
があった。そこで、医薬品企業法務研究会(医法研)が日本製薬医学会(JAPhMed)と共同
で作成し公開している契約書のサンプル書式を参考に、本学の実情に沿った契約書式とし
て一部改変し、共同臨床研究契約書(企業発案型)や研究者主導臨床研究書等 5 種類の契約
8