よむ、つかう、まなぶ。
資料4-4 企業から提出された開発工程表の概要等(第II回要望) (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
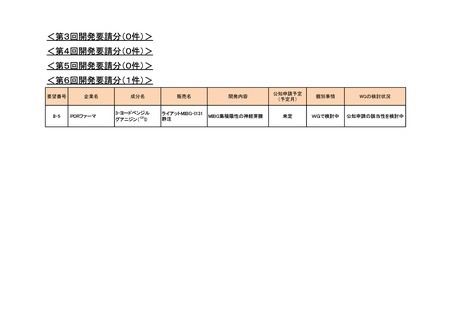
g. その他(1件)
<第1回開発要請分(0件)>
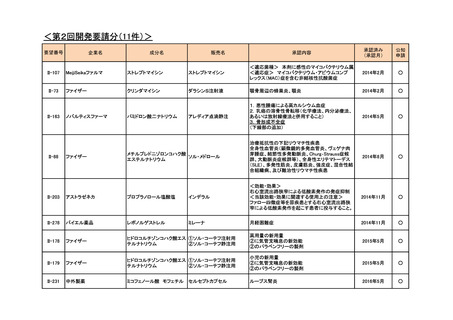
<第2回開発要請分(1件)>
要望番号
II-183
企業名
成分名
グラクソ・スミスクライ
ピリメタミン
ン
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
<第5回開発要請分(0件)>
<第6回開発要請分(0件)>
販売名
Daraprim
開発内容
治験計画届提出予定
(予定月)
トキソプラズマ脳症を含む重
症トキソプラズマ症の治療お
よび再発予防
-
個別事情
平成29年8月、海外で治験届を提出
<第1回開発要請分(0件)>
<第2回開発要請分(1件)>
要望番号
II-183
企業名
成分名
グラクソ・スミスクライ
ピリメタミン
ン
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
<第5回開発要請分(0件)>
<第6回開発要請分(0件)>
販売名
Daraprim
開発内容
治験計画届提出予定
(予定月)
トキソプラズマ脳症を含む重
症トキソプラズマ症の治療お
よび再発予防
-
個別事情
平成29年8月、海外で治験届を提出