よむ、つかう、まなぶ。
【資料4】薬事審議会における確認事項[834KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49875.html |
| 出典情報 | 薬事審議会(令和6年度第1回 総会 1/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
資料4
令和6年4月1日 薬事審議会確認
令和6年10月1日 一部改正
薬事審議会における確認事項
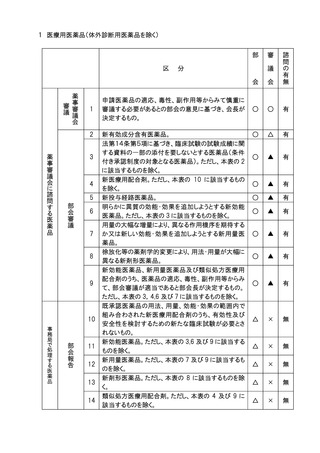
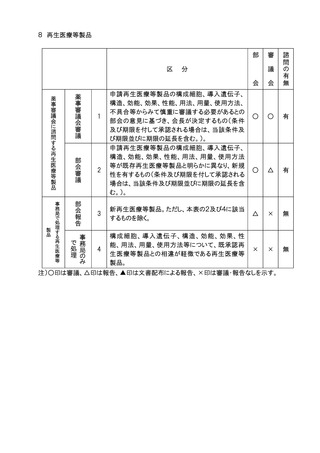
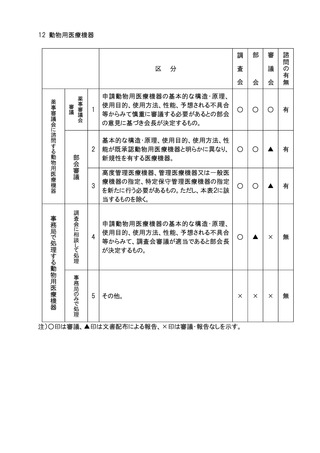
○ 医薬品等の承認申請等のうち審議会に諮問するものの取扱い
1.承認申請された医薬品等について、審議会への諮問の要否の判断は、別添の表に示
す例により事務局において行うこととし、例により難い場合は担当部会長の意見を聞いて
決定する。事務局は、承認申請後速やかに諮問を行い、諮問を行った品目の概要及び
当該品目の調査審議を調査会が行うものにあっては担当調査会名について、定期的に
担当部会に報告する。なお、事務局は諮問の要否の判断の経緯及び根拠を記録に残
すこととする。
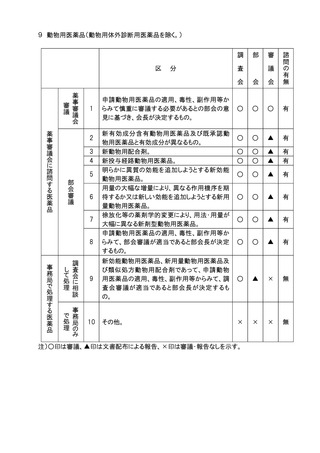
2.調査会を設ける部会の部会長は傘下の調査会に対し、当該調査会が調査審議すべき
事項の範囲を文書で示すこととする。
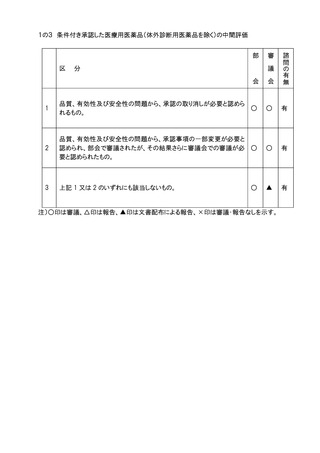
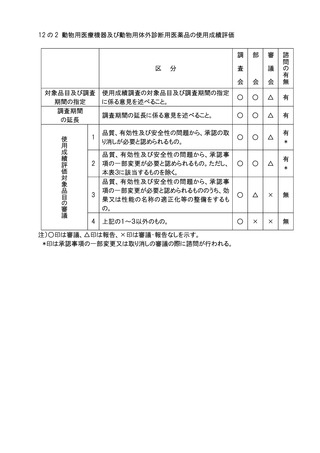
3.審議会に諮問を行ったものについての部会、審議会での審議又は報告の扱いは原則と
して別添の表に示す例による。部会は、審議終了後、審議会における審議又は報告の
扱いの案を作成し、会長の承認を得るものとする。また、表に示す例のいずれにも該当
しない場合は、その都度、担当部会長の意見を参考に会長が決定する。
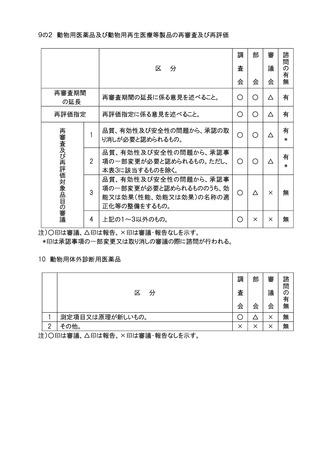
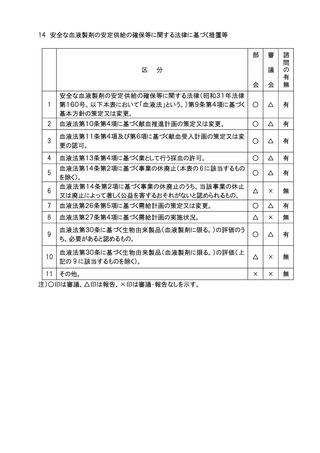
4.日本薬局方(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
(昭和35年法律第145号。以下「医薬品医療機器等法」という。)第41条に定めるもの)
の一部改正については部会審議、審議会報告の扱いとし、全面改正(大改正)の場合は、
部会審議、審議会審議の扱いとする。
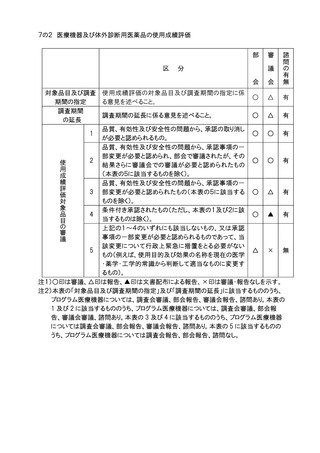
5.個別の医薬品等の承認に係る基準(医薬品医療機器等法第42条に基づき定めるもの
及びこれに準ずるもの)の一部改正(医薬品各条の制定、改正等)については、部会審
議、審議会報告の扱いとし、全面改正(基準の廃止、制定)の場合は部会審議、審議会
審議の扱いとする。
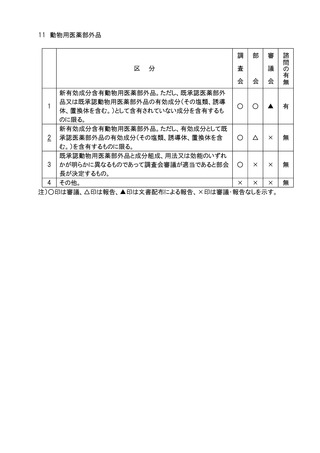
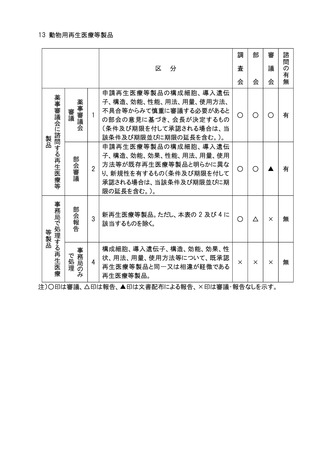
6.生物由来製品の指定(医薬品医療機器等法第2条第10項及び第11項に規定するも
の)の、個別品目の一部追加については、品目の承認に係る審議と同様の審議区分に
おいて部会審議、審議会審議又は報告の扱いとし、全面改正の場合は、部会審議、審
議会審議、一部変更については、部会審議、審議会報告の扱いとする。
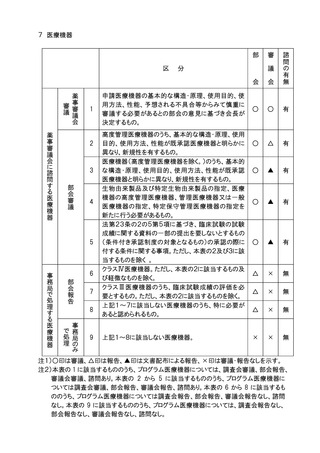
7.医療機器のクラス分類及び特定保守管理医療機器の指定(医薬品医療機器等法第2
条第5項から第8項までに規定するもの)の、個別品目の一部追加については、品目の
承認に係る審議と同様の審議区分において部会審議、審議会審議又は報告の扱いとし、
全面改正の場合は、部会審議、審議会審議、一部変更については、部会審議、審議会
令和6年4月1日 薬事審議会確認
令和6年10月1日 一部改正
薬事審議会における確認事項
○ 医薬品等の承認申請等のうち審議会に諮問するものの取扱い
1.承認申請された医薬品等について、審議会への諮問の要否の判断は、別添の表に示
す例により事務局において行うこととし、例により難い場合は担当部会長の意見を聞いて
決定する。事務局は、承認申請後速やかに諮問を行い、諮問を行った品目の概要及び
当該品目の調査審議を調査会が行うものにあっては担当調査会名について、定期的に
担当部会に報告する。なお、事務局は諮問の要否の判断の経緯及び根拠を記録に残
すこととする。
2.調査会を設ける部会の部会長は傘下の調査会に対し、当該調査会が調査審議すべき
事項の範囲を文書で示すこととする。
3.審議会に諮問を行ったものについての部会、審議会での審議又は報告の扱いは原則と
して別添の表に示す例による。部会は、審議終了後、審議会における審議又は報告の
扱いの案を作成し、会長の承認を得るものとする。また、表に示す例のいずれにも該当
しない場合は、その都度、担当部会長の意見を参考に会長が決定する。
4.日本薬局方(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
(昭和35年法律第145号。以下「医薬品医療機器等法」という。)第41条に定めるもの)
の一部改正については部会審議、審議会報告の扱いとし、全面改正(大改正)の場合は、
部会審議、審議会審議の扱いとする。
5.個別の医薬品等の承認に係る基準(医薬品医療機器等法第42条に基づき定めるもの
及びこれに準ずるもの)の一部改正(医薬品各条の制定、改正等)については、部会審
議、審議会報告の扱いとし、全面改正(基準の廃止、制定)の場合は部会審議、審議会
審議の扱いとする。
6.生物由来製品の指定(医薬品医療機器等法第2条第10項及び第11項に規定するも
の)の、個別品目の一部追加については、品目の承認に係る審議と同様の審議区分に
おいて部会審議、審議会審議又は報告の扱いとし、全面改正の場合は、部会審議、審
議会審議、一部変更については、部会審議、審議会報告の扱いとする。
7.医療機器のクラス分類及び特定保守管理医療機器の指定(医薬品医療機器等法第2
条第5項から第8項までに規定するもの)の、個別品目の一部追加については、品目の
承認に係る審議と同様の審議区分において部会審議、審議会審議又は報告の扱いとし、
全面改正の場合は、部会審議、審議会審議、一部変更については、部会審議、審議会