よむ、つかう、まなぶ。
【資料4】薬事審議会における確認事項[834KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49875.html |
| 出典情報 | 薬事審議会(令和6年度第1回 総会 1/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
報告の扱いとする。
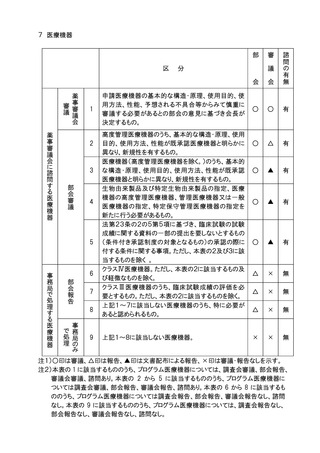
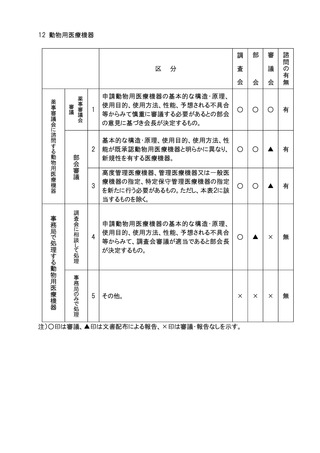
8.医療機器及び体外診断用医薬品の基準(医薬品医療機器等法第41条第3項に定め
るもの)の一部改正については、部会審議、審議会報告の扱いとし、全面改正(基準の
廃止、制定)の場合は、部会審議、審議会審議の扱いとする。
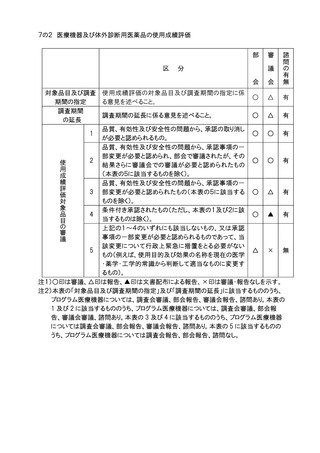
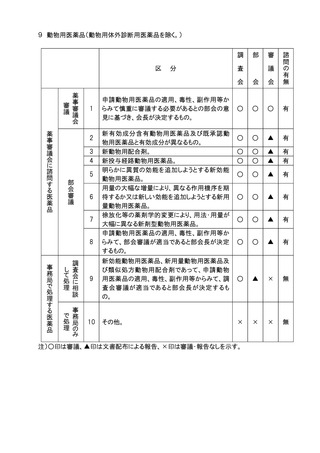
9.一般用医薬品の区分の指定及びその変更(医薬品医療機器等法第36条の7第3項に
規定するもの)については、部会審議、審議会報告の扱いとする。
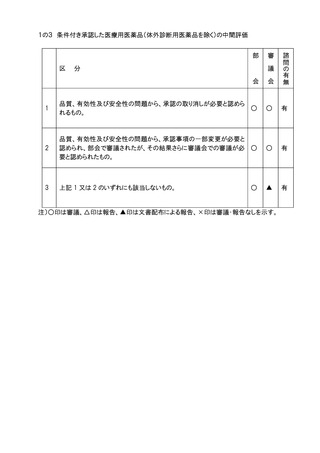
10.審議会における「審議」、「報告」の扱いの区別のうち、「報告」は事後報告(答申後)で
差し支えないこととする。
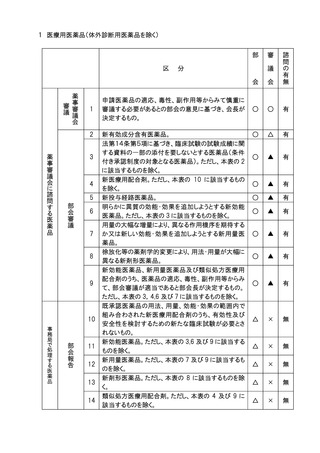
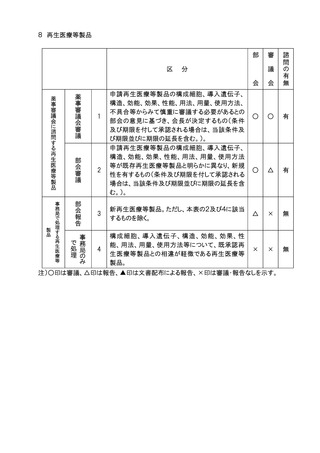
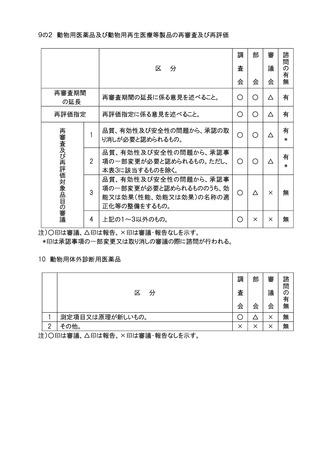
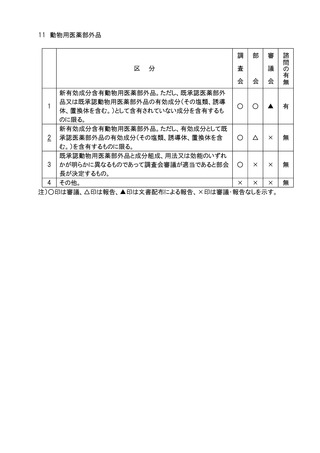
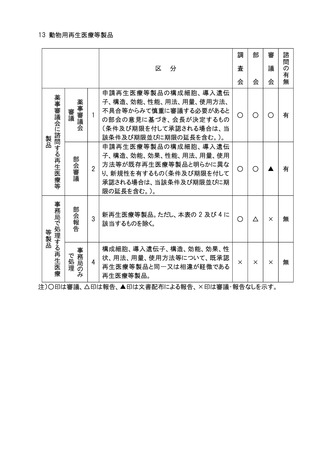
11.審議会審議の対象となる医療用医薬品(体外診断薬を除く。)、医療機器及び再生医
療等製品のうち、社会的関心の極めて高いものについては、主要な資料の概要を公表
し、広く一般の意見を求め、これを添えて審議会における審議の参考とする。
○ 医薬品医療機器等法の規定に基づき審議会に報告するものの取扱い
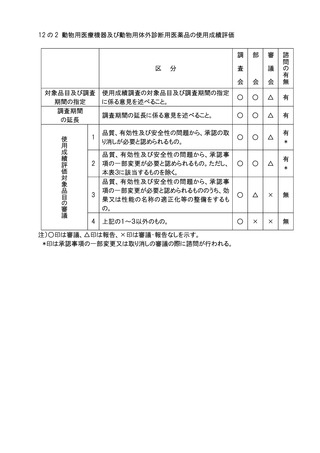
1.医薬品医療機器等法第68条の12第1項に基づく報告については、医薬品等安全対
策部会及び医療機器・再生医療等製品安全対策部会審議、審議会報告の扱いとする。
2.医薬品医療機器等法第68条の14第2項に基づく報告については、医療機器・再生医
療等製品安全対策部会審議、審議会報告の扱いとする。
3.医薬品医療機器等法第68条の24第2項に基づく報告については、血液事業部会、医
薬品等安全対策部会及び医療機器・再生医療等製品安全対策部会審議、審議会報
告の扱いとする。
○ 特殊疾病を定める政令の制定又は改廃の諮問の取扱い
医薬品医療機器等法第67条第2項に規定する政令の制定又は改廃のうち、他の法令の
改正等に伴う立法技術的な政令の改正については、同項ただし書に規定する軽微な事項
として、審議会への諮問を要しないこととする。
○ 安全な血液製剤の安定供給の確保等に関する法律の規定に基づき審議会に諮問するも
のの取扱い
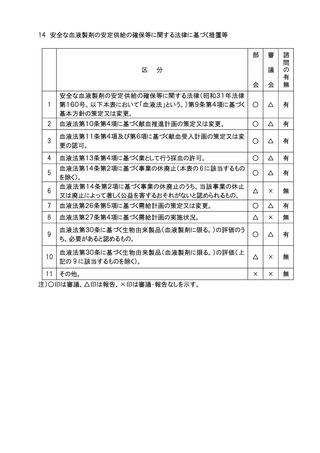
1.安全な血液製剤の安定供給の確保等に関する法律(昭和31年法律第160号)に基
づく措置等について、審議会への諮問の要否の判断は、別添の表に示す例により事務局
において行うこととし、例により難い場合は血液事業部会長の意見を聞いて決定する。
なお、事務局は諮問の要否に判断の経緯及び根拠を記録に残すこととする。
8.医療機器及び体外診断用医薬品の基準(医薬品医療機器等法第41条第3項に定め
るもの)の一部改正については、部会審議、審議会報告の扱いとし、全面改正(基準の
廃止、制定)の場合は、部会審議、審議会審議の扱いとする。
9.一般用医薬品の区分の指定及びその変更(医薬品医療機器等法第36条の7第3項に
規定するもの)については、部会審議、審議会報告の扱いとする。
10.審議会における「審議」、「報告」の扱いの区別のうち、「報告」は事後報告(答申後)で
差し支えないこととする。
11.審議会審議の対象となる医療用医薬品(体外診断薬を除く。)、医療機器及び再生医
療等製品のうち、社会的関心の極めて高いものについては、主要な資料の概要を公表
し、広く一般の意見を求め、これを添えて審議会における審議の参考とする。
○ 医薬品医療機器等法の規定に基づき審議会に報告するものの取扱い
1.医薬品医療機器等法第68条の12第1項に基づく報告については、医薬品等安全対
策部会及び医療機器・再生医療等製品安全対策部会審議、審議会報告の扱いとする。
2.医薬品医療機器等法第68条の14第2項に基づく報告については、医療機器・再生医
療等製品安全対策部会審議、審議会報告の扱いとする。
3.医薬品医療機器等法第68条の24第2項に基づく報告については、血液事業部会、医
薬品等安全対策部会及び医療機器・再生医療等製品安全対策部会審議、審議会報
告の扱いとする。
○ 特殊疾病を定める政令の制定又は改廃の諮問の取扱い
医薬品医療機器等法第67条第2項に規定する政令の制定又は改廃のうち、他の法令の
改正等に伴う立法技術的な政令の改正については、同項ただし書に規定する軽微な事項
として、審議会への諮問を要しないこととする。
○ 安全な血液製剤の安定供給の確保等に関する法律の規定に基づき審議会に諮問するも
のの取扱い
1.安全な血液製剤の安定供給の確保等に関する法律(昭和31年法律第160号)に基
づく措置等について、審議会への諮問の要否の判断は、別添の表に示す例により事務局
において行うこととし、例により難い場合は血液事業部会長の意見を聞いて決定する。
なお、事務局は諮問の要否に判断の経緯及び根拠を記録に残すこととする。