よむ、つかう、まなぶ。
【資料4】薬事審議会における確認事項[834KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49875.html |
| 出典情報 | 薬事審議会(令和6年度第1回 総会 1/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
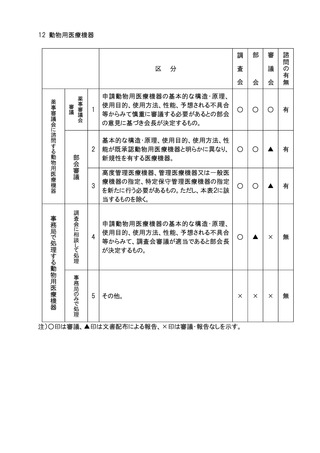
7 医療機器
部
区
薬
審事
議審
議
会
薬
事
審
議
会
に
諮
問
す
る
医
療
機
器
1
2
3
部
会
審
議
4
5
事
務
局
で
処
理
す
る
医
療
機
器
6
部
会
報
告
7
8
事
で務
処局
理の
み
9
会
会
諮
問
の
有
無
○
○
有
○
△
有
○
▲
有
○
▲
有
○
▲
有
△
×
無
△
×
無
△
×
無
×
×
無
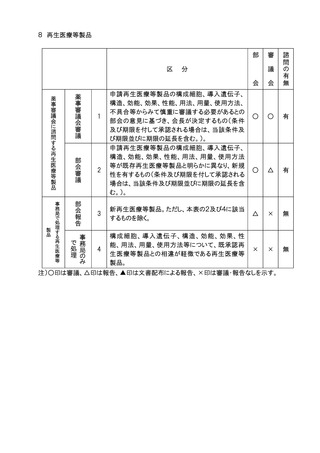
分
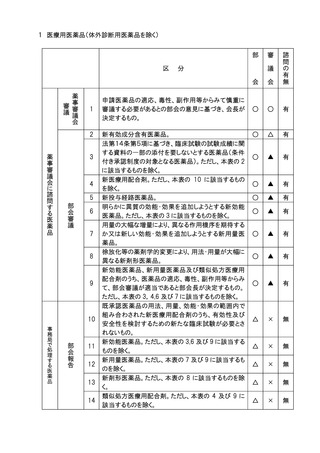
申請医療機器の基本的な構造・原理、使用目的、使
用方法、性能、予想される不具合等からみて慎重に
審議する必要があるとの部会の意見に基づき会長が
決定するもの。
高度管理医療機器のうち、基本的な構造・原理、使用
目的、使用方法、性能が既承認医療機器と明らかに
異なり、新規性を有するもの。
医療機器(高度管理医療機器を除く。)のうち、基本的
な構造・原理、使用目的、使用方法、性能が既承認
医療機器と明らかに異なり、新規性を有するもの。
生物由来製品及び特定生物由来製品の指定、医療
機器の高度管理医療機器、管理医療機器又は一般
医療機器の指定、特定保守管理医療機器の指定を
新たに行う必要があるもの。
法第23条の2の5第5項に基づき、臨床試験の試験
成績に関する資料の一部の提出を要しないとするもの
(条件付き承認制度の対象となるもの)の承認の際に
付する条件に関する事項。ただし、本表の2及び3に該
当するものを除く 。
クラスⅣ医療機器。ただし、本表の2に該当するもの及
び軽微なものを除く。
クラスⅢ医療機器のうち、臨床試験成績の評価を必
要とするもの。ただし、本表の2に該当するものを除く。
上記1~7に該当しない医療機器のうち、特に必要が
あると認められるもの。
上記1~8に該当しない医療機器。
審
議
注1)○印は審議、△印は報告、▲印は文書配布による報告、×印は審議・報告なしを示す。
注2)本表の 1 に該当するもののうち、プログラム医療機器については、調査会審議、部会報告、
審議会審議、諮問あり。本表の 2 から 5 に該当するもののうち、プログラム医療機器に
ついては調査会審議、部会報告、審議会報告、諮問あり。本表の 6 から 8 に該当するも
ののうち、プログラム医療機器については調査会報告、部会報告、審議会報告なし、諮問
なし。本表の 9 に該当するもののうち、プログラム医療機器については、調査会報告なし、
部会報告なし、審議会報告なし、諮問なし。
部
区
薬
審事
議審
議
会
薬
事
審
議
会
に
諮
問
す
る
医
療
機
器
1
2
3
部
会
審
議
4
5
事
務
局
で
処
理
す
る
医
療
機
器
6
部
会
報
告
7
8
事
で務
処局
理の
み
9
会
会
諮
問
の
有
無
○
○
有
○
△
有
○
▲
有
○
▲
有
○
▲
有
△
×
無
△
×
無
△
×
無
×
×
無
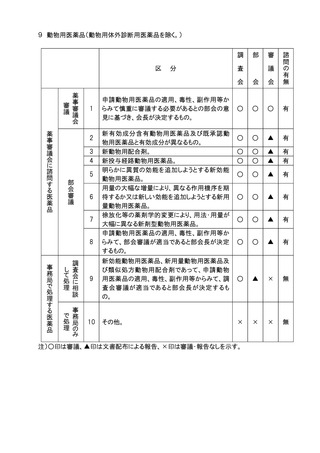
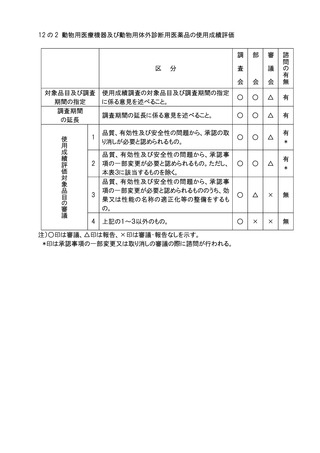
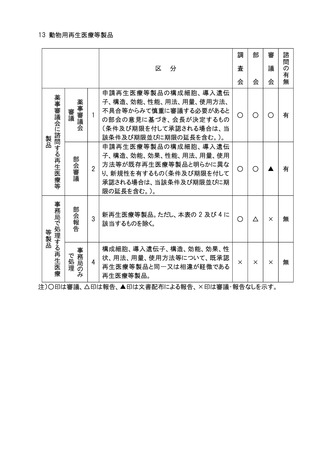
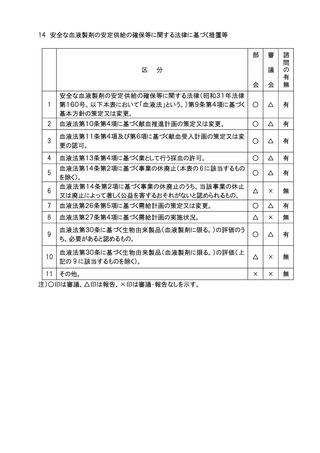
分
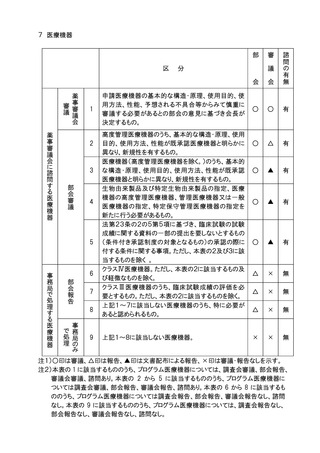
申請医療機器の基本的な構造・原理、使用目的、使
用方法、性能、予想される不具合等からみて慎重に
審議する必要があるとの部会の意見に基づき会長が
決定するもの。
高度管理医療機器のうち、基本的な構造・原理、使用
目的、使用方法、性能が既承認医療機器と明らかに
異なり、新規性を有するもの。
医療機器(高度管理医療機器を除く。)のうち、基本的
な構造・原理、使用目的、使用方法、性能が既承認
医療機器と明らかに異なり、新規性を有するもの。
生物由来製品及び特定生物由来製品の指定、医療
機器の高度管理医療機器、管理医療機器又は一般
医療機器の指定、特定保守管理医療機器の指定を
新たに行う必要があるもの。
法第23条の2の5第5項に基づき、臨床試験の試験
成績に関する資料の一部の提出を要しないとするもの
(条件付き承認制度の対象となるもの)の承認の際に
付する条件に関する事項。ただし、本表の2及び3に該
当するものを除く 。
クラスⅣ医療機器。ただし、本表の2に該当するもの及
び軽微なものを除く。
クラスⅢ医療機器のうち、臨床試験成績の評価を必
要とするもの。ただし、本表の2に該当するものを除く。
上記1~7に該当しない医療機器のうち、特に必要が
あると認められるもの。
上記1~8に該当しない医療機器。
審
議
注1)○印は審議、△印は報告、▲印は文書配布による報告、×印は審議・報告なしを示す。
注2)本表の 1 に該当するもののうち、プログラム医療機器については、調査会審議、部会報告、
審議会審議、諮問あり。本表の 2 から 5 に該当するもののうち、プログラム医療機器に
ついては調査会審議、部会報告、審議会報告、諮問あり。本表の 6 から 8 に該当するも
ののうち、プログラム医療機器については調査会報告、部会報告、審議会報告なし、諮問
なし。本表の 9 に該当するもののうち、プログラム医療機器については、調査会報告なし、
部会報告なし、審議会報告なし、諮問なし。