よむ、つかう、まなぶ。
総-4-1○最適使用推進ガイドラインについて (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00160.html |
| 出典情報 | 中央社会保険医療協議会 総会(第528回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
6.投与に際して留意すべき事項
① 添付文書等に加え、製造販売業者が提供する資料等に基づき本剤の特性及び適正使
用のために必要な情報を十分に理解してから使用すること。
② 治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得
てから投与すること。
③ 主な副作用のマネジメントについて
間質性肺疾患があらわれることがあるので、本剤の投与にあたっては、初期症
状(息切れ、呼吸困難、咳嗽等)の確認及び胸部 X 線検査の実施等、観察を十
分に行うこと。また、必要に応じて胸部 CT、血清マーカー等の検査を実施す
ること。
infusion reaction があらわれることがある。infusion reaction が認められた場合に
は、適切な処置を行うとともに、症状が回復するまで患者の状態を十分に観察
すること。
甲状腺機能障害、下垂体機能障害及び副腎機能障害があらわれることがあるの
で、本剤の投与開始前及び投与期間中は定期的に内分泌機能検査(TSH、遊離
T3、遊離 T4、ACTH、血中コルチゾール等の測定)を実施すること。
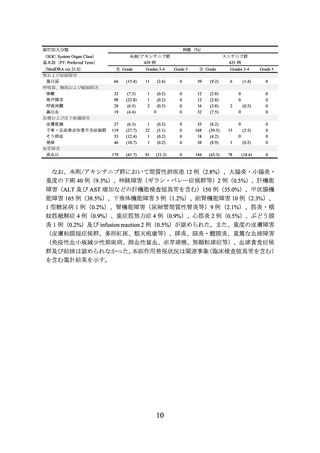
劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎があらわれることがある
ので、本剤の投与開始前及び投与期間中は定期的に肝機能検査(AST、ALT、
γ-GTP、Al-P、ビリルビン等の測定)を実施すること。
ぶどう膜炎(虹彩炎及び虹彩毛様体炎を含む)等の重篤な眼障害があらわれる
ことがあるので、定期的に眼の異常の有無を確認すること。また、眼の異常が
認められた場合には、速やかに医療機関を受診するよう患者を指導すること。
本剤の投与により、過度の免疫反応に起因すると考えられる様々な疾患や病態
があらわれることがある。異常が認められた場合には、発現した事象に応じた
専門的な知識と経験を持つ医師と連携して適切な鑑別診断を行い、過度の免疫
反応による副作用が疑われる場合には、本剤の休薬又は中止、及び副腎皮質ホ
ルモン剤の投与等を考慮すること。なお、副腎皮質ホルモンの投与により副作
用の改善が認められない場合には、副腎皮質ホルモン以外の免疫抑制剤の追加
も考慮すること。
投与終了後、数週間から数カ月経過してから副作用が発現することがあるため、
本剤の投与終了後にも副作用の発現に十分に注意すること。
1 型糖尿病(劇症 1 型糖尿病を含む)があらわれ、糖尿病性ケトアシドーシス
に至ることがあるので、口渇、悪心、嘔吐等の症状の発現や血糖値の上昇に十
分注意すること。1 型糖尿病が疑われた場合には投与を中止し、インスリン製
剤の投与等の適切な処置を行うこと。
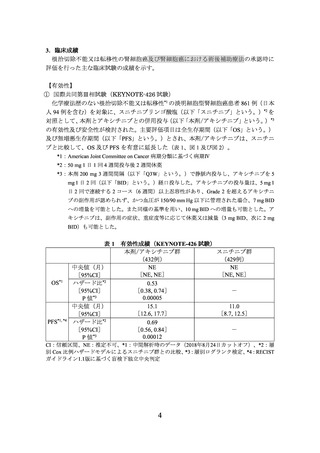
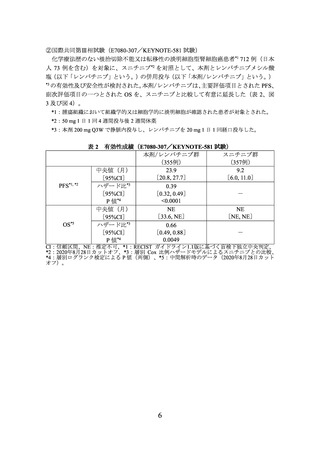
④ 本剤の臨床試験において、KEYNOTE-426 試験では投与開始から 12 週目、以降は
54 週目まで 6 週ごと、その後 12 週ごと、E7080-307/KEYNOTE-581 試験では投与
開始から 8 週間ごとに有効性の評価を行っていたことを参考に、本剤投与中は定期
的に画像検査で効果の確認を行うこと。
⑤ 再発リスクの高い腎細胞癌患者における術後補助療法として使用する際には、
KEYNOTE-564 試験において、12 週間ごとに有効性の評価を行っていたことを参考
19
① 添付文書等に加え、製造販売業者が提供する資料等に基づき本剤の特性及び適正使
用のために必要な情報を十分に理解してから使用すること。
② 治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得
てから投与すること。
③ 主な副作用のマネジメントについて
間質性肺疾患があらわれることがあるので、本剤の投与にあたっては、初期症
状(息切れ、呼吸困難、咳嗽等)の確認及び胸部 X 線検査の実施等、観察を十
分に行うこと。また、必要に応じて胸部 CT、血清マーカー等の検査を実施す
ること。
infusion reaction があらわれることがある。infusion reaction が認められた場合に
は、適切な処置を行うとともに、症状が回復するまで患者の状態を十分に観察
すること。
甲状腺機能障害、下垂体機能障害及び副腎機能障害があらわれることがあるの
で、本剤の投与開始前及び投与期間中は定期的に内分泌機能検査(TSH、遊離
T3、遊離 T4、ACTH、血中コルチゾール等の測定)を実施すること。
劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎があらわれることがある
ので、本剤の投与開始前及び投与期間中は定期的に肝機能検査(AST、ALT、
γ-GTP、Al-P、ビリルビン等の測定)を実施すること。
ぶどう膜炎(虹彩炎及び虹彩毛様体炎を含む)等の重篤な眼障害があらわれる
ことがあるので、定期的に眼の異常の有無を確認すること。また、眼の異常が
認められた場合には、速やかに医療機関を受診するよう患者を指導すること。
本剤の投与により、過度の免疫反応に起因すると考えられる様々な疾患や病態
があらわれることがある。異常が認められた場合には、発現した事象に応じた
専門的な知識と経験を持つ医師と連携して適切な鑑別診断を行い、過度の免疫
反応による副作用が疑われる場合には、本剤の休薬又は中止、及び副腎皮質ホ
ルモン剤の投与等を考慮すること。なお、副腎皮質ホルモンの投与により副作
用の改善が認められない場合には、副腎皮質ホルモン以外の免疫抑制剤の追加
も考慮すること。
投与終了後、数週間から数カ月経過してから副作用が発現することがあるため、
本剤の投与終了後にも副作用の発現に十分に注意すること。
1 型糖尿病(劇症 1 型糖尿病を含む)があらわれ、糖尿病性ケトアシドーシス
に至ることがあるので、口渇、悪心、嘔吐等の症状の発現や血糖値の上昇に十
分注意すること。1 型糖尿病が疑われた場合には投与を中止し、インスリン製
剤の投与等の適切な処置を行うこと。
④ 本剤の臨床試験において、KEYNOTE-426 試験では投与開始から 12 週目、以降は
54 週目まで 6 週ごと、その後 12 週ごと、E7080-307/KEYNOTE-581 試験では投与
開始から 8 週間ごとに有効性の評価を行っていたことを参考に、本剤投与中は定期
的に画像検査で効果の確認を行うこと。
⑤ 再発リスクの高い腎細胞癌患者における術後補助療法として使用する際には、
KEYNOTE-564 試験において、12 週間ごとに有効性の評価を行っていたことを参考
19