よむ、つかう、まなぶ。
参考資料1 新規に接種が開始される新型コロナワクチンの副反応に係る取扱いについて(令和4年10月11日第86回厚生科学審議会予防接種・ワクチン分科会副反応検討部会資料1) (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
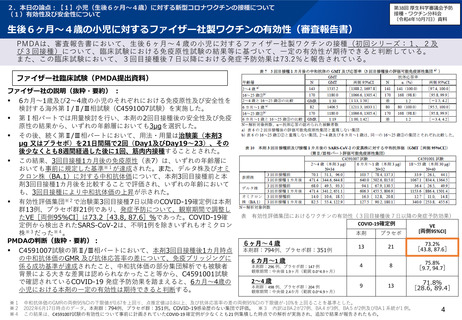
ファイザー社製ワクチン6ヵ月~4歳用の副反応疑い報告基準の設定について
●添付文書の「重大な副反応」として記載されている症状について
○ ファイザー社製ワクチン6ヵ月~4歳用の添付文書において、「重大な副反応」に記載されている症状は、
同社製の従来型ワクチン(12歳以上用及び5~11歳用)及びオミクロン株BA.1対応ワクチンと同様に、
「ショック、アナフィラキシー」「心筋炎、心膜炎」となっている。
●その他の安全性プロファイルについて
○ ファイザー社製ワクチン6ヵ月~4歳用の初回接種の安全性については、審査報告書において、「被験者の
多くに認められた反応原性事象(局所反応及び全身反応)のほとんどは軽度又は中等度であり回復性が認めら
れている。また、反応原性事象以外の有害事象の発現割合は低く、ほとんどは軽度又は中等度であること等を
確認し、現時点で得られている情報からは、6カ月~4歳の小児における本剤の安全性に重大な懸念は認められ
ていないと判断した。」とされている。
論点
○ ファイザー社製ワクチン6ヵ月~4歳用の「アナフィラキシー」「心筋炎、心膜炎」については、本剤の審査
報告時点では報告がなく知見に乏しいものの、アナフィラキシーはワクチン全般に発現する可能性があり、また、
本剤の臨床試験においては発症は確認されていないが、新型コロナウイルスに対するmRNAワクチンの接種後に
心筋炎を発症した事例が報告されていることを踏まえて、重要な潜在的リスクとして本剤の添付文書の「重大な
副反応」に記載されていることから、他の新型コロナワクチンと同様に副反応疑い報告基準として扱っていくこ
とでよいか。
○
現時点においては添付文書上の記載はないが、「血小板減少を伴う血栓症、その他」については、臨時接種の
対象となっている全ての新型コロナワクチンと同様、ファイザー社製ワクチン6ヵ月~4歳用の副反応疑い報告
基準として扱っていくことでよいか。
25
●添付文書の「重大な副反応」として記載されている症状について
○ ファイザー社製ワクチン6ヵ月~4歳用の添付文書において、「重大な副反応」に記載されている症状は、
同社製の従来型ワクチン(12歳以上用及び5~11歳用)及びオミクロン株BA.1対応ワクチンと同様に、
「ショック、アナフィラキシー」「心筋炎、心膜炎」となっている。
●その他の安全性プロファイルについて
○ ファイザー社製ワクチン6ヵ月~4歳用の初回接種の安全性については、審査報告書において、「被験者の
多くに認められた反応原性事象(局所反応及び全身反応)のほとんどは軽度又は中等度であり回復性が認めら
れている。また、反応原性事象以外の有害事象の発現割合は低く、ほとんどは軽度又は中等度であること等を
確認し、現時点で得られている情報からは、6カ月~4歳の小児における本剤の安全性に重大な懸念は認められ
ていないと判断した。」とされている。
論点
○ ファイザー社製ワクチン6ヵ月~4歳用の「アナフィラキシー」「心筋炎、心膜炎」については、本剤の審査
報告時点では報告がなく知見に乏しいものの、アナフィラキシーはワクチン全般に発現する可能性があり、また、
本剤の臨床試験においては発症は確認されていないが、新型コロナウイルスに対するmRNAワクチンの接種後に
心筋炎を発症した事例が報告されていることを踏まえて、重要な潜在的リスクとして本剤の添付文書の「重大な
副反応」に記載されていることから、他の新型コロナワクチンと同様に副反応疑い報告基準として扱っていくこ
とでよいか。
○
現時点においては添付文書上の記載はないが、「血小板減少を伴う血栓症、その他」については、臨時接種の
対象となっている全ての新型コロナワクチンと同様、ファイザー社製ワクチン6ヵ月~4歳用の副反応疑い報告
基準として扱っていくことでよいか。
25