よむ、つかう、まなぶ。
資料1-8 副反応疑い報告の状況について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00055.html |
| 出典情報 | 第 88 回厚生科学審議会予防接種・ワクチン分科会 副反応検討部会、令和4年度第 18 回薬事・食品衛生審 議会薬事分科会医薬品等安全対策部会安全対策調査会(11/11)《厚生労働省》 |
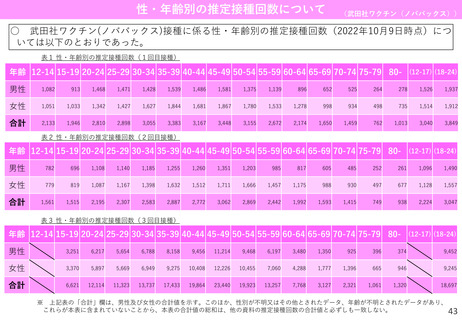
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
6か月~4歳の乳幼児を対象とした接種後の健康状況に係る調査の概要(案)①
•
新型コロナワクチンの接種は予防接種法に基づく臨時接種の枠組みで実施され、短期間で多数の方に接種を行うことが見込まれる。このた
め、厚生労働科学研究として、乳幼児(6か月~4歳)を対象とした接種においても、臨時接種の対象となるワクチンについて、接種する
希望者を対象とする調査を行い、その結果を公表することによって、国民に、接種後の状況を情報提供する。
【主な調査項目】
① ワクチン接種(1~3回目)後それぞれ28日(1か月)までに発現した
体温、接種部位反応、全身症状の有無、副反応疑い報告、SAE※(因果関係問わず)、胸痛発現時の詳細情報
② ①に加え、最終接種後12か月までの新型コロナウイルスの感染状況、副反応疑い報告、SAE※(因果関係問わず)
③ ワクチン1回目接種時、及び最終接種後1, 3, 6か月* における新型コロナウイルスに対する血中抗体価(参加者の一部)
*観察期間中にさらに追加的に接種を実施した場合は、当該接種後の抗体価測定は実施しない
採血
抗体価測定
同
意
取
得
(
問 1
診回
/目
接接
種種
)
予診票
接
種
後
1
週
日誌
問(
2
診回
/目
接接
種種
)
問(
3
診回
/目
接接
種種
)
接
種
後
1
週
日誌・予診票
日誌
接
種
後
1
週
日誌・予診票
接
種
後
1
月
接
種
後
3
月
接
種
後
6
月
SAE情報は
随時収集
日誌
日誌
調査票
調査票
接
種
後
12
月
調査票
• 調査参加者が記入する日誌は、1~3回目接種を受けた日をそれぞれ1日目として8日目まで毎日記入するほか、9日目以降はAE※があれ
ば記入
• 予診票、観察日誌は、回収後、各病院等においてシステム上に入力し、電子的に研究班事務局に提出
• 採血は、事前に同意を得た一定数の参加者について実施。血中抗体価の測定は、外部の検査受託会社により行う
• 研究班事務局は、収集したデータを集計・解析。結果は定期的に厚生労働省に報告するとともに、審議会において公表
• 上記とは別に、対象となる事象が発生した場合には、予防接種法に基づく「副反応疑い報告」を速やかに実施
※ 「AE(Adverse Event)」とは、医薬品の使用と時間的に関連のある、あらゆる好ましくない、意図しない徴候、症状又は疾病のことであり、当該医薬品との因果関係の有無は問わな
い。例えば、ワクチン接種後に地震が発生して負傷した場合も、ワクチン接種との因果関係にかかわらず、時間的な関連があるためAEとして扱われる。「SAE (Serious Adverse
Event) 」は重篤なAEをいう。
25
•
新型コロナワクチンの接種は予防接種法に基づく臨時接種の枠組みで実施され、短期間で多数の方に接種を行うことが見込まれる。このた
め、厚生労働科学研究として、乳幼児(6か月~4歳)を対象とした接種においても、臨時接種の対象となるワクチンについて、接種する
希望者を対象とする調査を行い、その結果を公表することによって、国民に、接種後の状況を情報提供する。
【主な調査項目】
① ワクチン接種(1~3回目)後それぞれ28日(1か月)までに発現した
体温、接種部位反応、全身症状の有無、副反応疑い報告、SAE※(因果関係問わず)、胸痛発現時の詳細情報
② ①に加え、最終接種後12か月までの新型コロナウイルスの感染状況、副反応疑い報告、SAE※(因果関係問わず)
③ ワクチン1回目接種時、及び最終接種後1, 3, 6か月* における新型コロナウイルスに対する血中抗体価(参加者の一部)
*観察期間中にさらに追加的に接種を実施した場合は、当該接種後の抗体価測定は実施しない
採血
抗体価測定
同
意
取
得
(
問 1
診回
/目
接接
種種
)
予診票
接
種
後
1
週
日誌
問(
2
診回
/目
接接
種種
)
問(
3
診回
/目
接接
種種
)
接
種
後
1
週
日誌・予診票
日誌
接
種
後
1
週
日誌・予診票
接
種
後
1
月
接
種
後
3
月
接
種
後
6
月
SAE情報は
随時収集
日誌
日誌
調査票
調査票
接
種
後
12
月
調査票
• 調査参加者が記入する日誌は、1~3回目接種を受けた日をそれぞれ1日目として8日目まで毎日記入するほか、9日目以降はAE※があれ
ば記入
• 予診票、観察日誌は、回収後、各病院等においてシステム上に入力し、電子的に研究班事務局に提出
• 採血は、事前に同意を得た一定数の参加者について実施。血中抗体価の測定は、外部の検査受託会社により行う
• 研究班事務局は、収集したデータを集計・解析。結果は定期的に厚生労働省に報告するとともに、審議会において公表
• 上記とは別に、対象となる事象が発生した場合には、予防接種法に基づく「副反応疑い報告」を速やかに実施
※ 「AE(Adverse Event)」とは、医薬品の使用と時間的に関連のある、あらゆる好ましくない、意図しない徴候、症状又は疾病のことであり、当該医薬品との因果関係の有無は問わな
い。例えば、ワクチン接種後に地震が発生して負傷した場合も、ワクチン接種との因果関係にかかわらず、時間的な関連があるためAEとして扱われる。「SAE (Serious Adverse
Event) 」は重篤なAEをいう。
25