よむ、つかう、まなぶ。
04資料2 新型コロナワクチンに関する資料 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00026.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第51回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
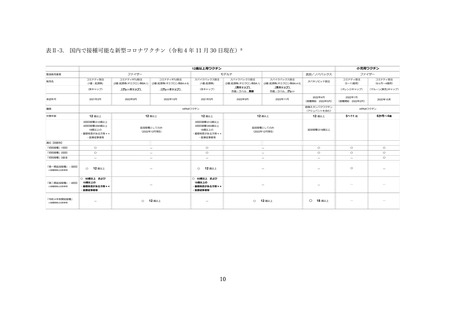
(2) 安全性の評価
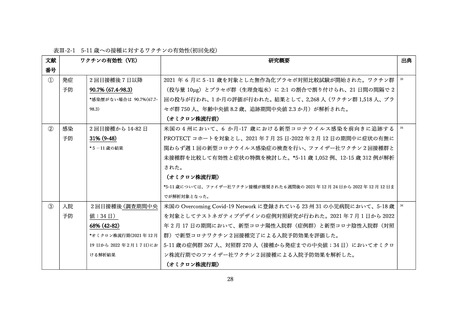
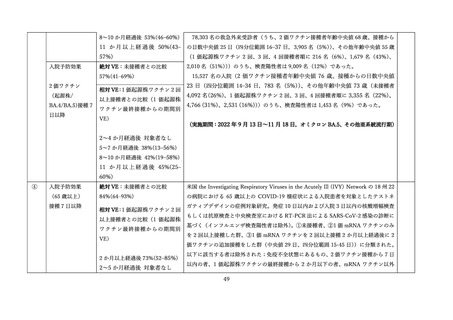
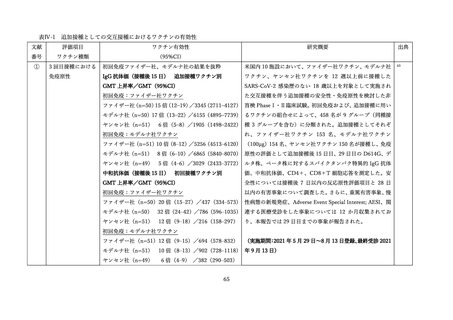
上記審査報告書の臨床試験の報告では、5-11 歳に対する 3 回目接種後の安全性においても評価された
(表Ⅲ-2-6)
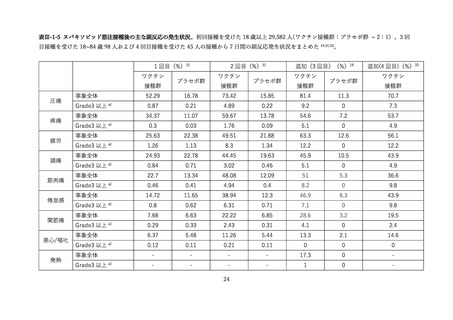
。反応原性の事象では、3回目接種後の頭痛、筋肉痛及び関節痛の発現割合は、初回免疫(1
回目及び 2 回目接種)後よりも高かった。Grade3 以上の発現割合が 1%以上の 3 回目接種後の反応原生
事象は疲労であった。Grade4 の反応原性事象の発現はなかった。
有害事象については、本剤 3 回目接種後 28 日までの有害事象の発現割合は 9.0%(36/401 例)であり、
主な有害事象はリンパ節症 2.0%
(8/401 例)
(リンパ節触知または腋窩腫瘤を含めると 2.5%
(10/401 例))
であり、すべて本剤との因果関係ありと判断され、全ての症例において 3 回目接種あと2日で発現し、
約1週間で消失した。本試験において、5-11 歳の小児に対する 3 回目接種後の心筋炎又は心膜炎の発現
は認められなかった。
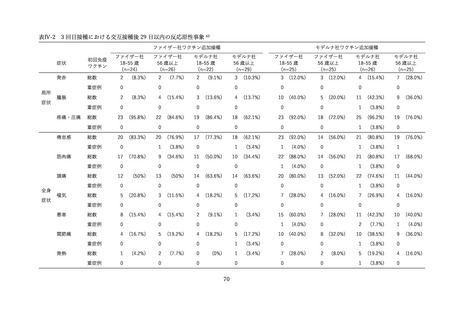
表Ⅲ-2-6 各回接種後7日間における反応原性事象(II/Ⅲ相パート安全性解析対象集団)42
接種回
追加免疫
追加免疫
3 回目(N= 371)
事象名
1 回目(N= 398)
2 回目(N= 399)
全体
Grade3 以上
全体
Grade3 以上
全体
Grade3 以上
局所反応(全体)
278 (74.9)
-
315 (79 1)
-
296 (74.2)
-
注射部位疼痛
274 (73.9)
2 (0.5)
309 (77.6)
0
288 (72.2)
1 (0.3)
腫脹
61 (16.4)
0
38 (95)
0
56 (14.0)
0
発赤
58 (15.6)
1(0.3)
46 (11.6)
0
66 (16.5)
1(0.3)
全身反応(全体)
220 (59.3)
-
202 (50.8)
-
230 (57.6)
-
疲労
169 (45.6)
7(1.9)
149 (37.4)
1 (0.3)
186 (46.6)
4(1.0)
頭痛
126 (34.0)
3(0.8)
94 (23.6)
0
120 (30.1)
2 (0.5)
筋肉痛
68 (18.3)
0
32 (8.0)
0
50 (12.5)
1 (0.3)
悪寒
39 (10.5)
1 (0.3)
24 (6.0)
0
41 (10.3)
1 (0.3)
関節痛
25 (6.7)
0
15 (3.8)
0
22 (5.5)
0
下痢
18 (4.9)
1(0.3)
27 (6.8)
0
26 (6.5)
0
発熱 a)
25 (6.7)
-
14(35)
-
35 (8.8)
-
嘔吐
9 (2.4)
0
8(2.0)
0
7 (1.8)
0
例数(%)
、N=解析対象例数(被験者日誌で自称の発言有無に関する記入があった例数)
38℃以上。Grade 分類されていない。
a)
米国の報告では、2022 年5月 17 日から 7 月 31 日の期間にファイザー社ワクチンの3回目接種を受け
た 5-11 歳の小児のうち、v-safe(スマートフォンを用い、任意で新型コロナワクチン接種後の有害事象
を入力することで安全性をモニタリングするシステム)
、VAERS(予防接種後の有害事象を受動的に収集
しモニタリングするシステム)に報告された情報について解析が行われた。米国では当該期間中に約
657,302 人の 5-11 歳の小児がファイザー社のワクチンによる 3 回目の接種を受けた。v-safe の登録者の
うち、1-3 回目の全てをファイザー社ワクチンで接種した 3,249 例が解析された 44(表Ⅲ-2-7)。局所反応
37
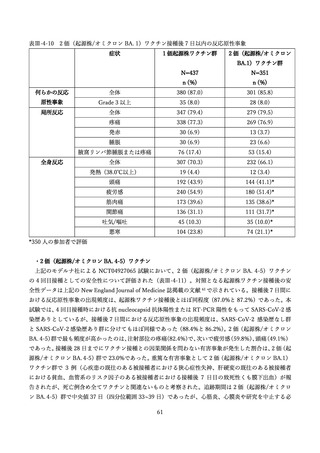
上記審査報告書の臨床試験の報告では、5-11 歳に対する 3 回目接種後の安全性においても評価された
(表Ⅲ-2-6)
。反応原性の事象では、3回目接種後の頭痛、筋肉痛及び関節痛の発現割合は、初回免疫(1
回目及び 2 回目接種)後よりも高かった。Grade3 以上の発現割合が 1%以上の 3 回目接種後の反応原生
事象は疲労であった。Grade4 の反応原性事象の発現はなかった。
有害事象については、本剤 3 回目接種後 28 日までの有害事象の発現割合は 9.0%(36/401 例)であり、
主な有害事象はリンパ節症 2.0%
(8/401 例)
(リンパ節触知または腋窩腫瘤を含めると 2.5%
(10/401 例))
であり、すべて本剤との因果関係ありと判断され、全ての症例において 3 回目接種あと2日で発現し、
約1週間で消失した。本試験において、5-11 歳の小児に対する 3 回目接種後の心筋炎又は心膜炎の発現
は認められなかった。
表Ⅲ-2-6 各回接種後7日間における反応原性事象(II/Ⅲ相パート安全性解析対象集団)42
接種回
追加免疫
追加免疫
3 回目(N= 371)
事象名
1 回目(N= 398)
2 回目(N= 399)
全体
Grade3 以上
全体
Grade3 以上
全体
Grade3 以上
局所反応(全体)
278 (74.9)
-
315 (79 1)
-
296 (74.2)
-
注射部位疼痛
274 (73.9)
2 (0.5)
309 (77.6)
0
288 (72.2)
1 (0.3)
腫脹
61 (16.4)
0
38 (95)
0
56 (14.0)
0
発赤
58 (15.6)
1(0.3)
46 (11.6)
0
66 (16.5)
1(0.3)
全身反応(全体)
220 (59.3)
-
202 (50.8)
-
230 (57.6)
-
疲労
169 (45.6)
7(1.9)
149 (37.4)
1 (0.3)
186 (46.6)
4(1.0)
頭痛
126 (34.0)
3(0.8)
94 (23.6)
0
120 (30.1)
2 (0.5)
筋肉痛
68 (18.3)
0
32 (8.0)
0
50 (12.5)
1 (0.3)
悪寒
39 (10.5)
1 (0.3)
24 (6.0)
0
41 (10.3)
1 (0.3)
関節痛
25 (6.7)
0
15 (3.8)
0
22 (5.5)
0
下痢
18 (4.9)
1(0.3)
27 (6.8)
0
26 (6.5)
0
発熱 a)
25 (6.7)
-
14(35)
-
35 (8.8)
-
嘔吐
9 (2.4)
0
8(2.0)
0
7 (1.8)
0
例数(%)
、N=解析対象例数(被験者日誌で自称の発言有無に関する記入があった例数)
38℃以上。Grade 分類されていない。
a)
米国の報告では、2022 年5月 17 日から 7 月 31 日の期間にファイザー社ワクチンの3回目接種を受け
た 5-11 歳の小児のうち、v-safe(スマートフォンを用い、任意で新型コロナワクチン接種後の有害事象
を入力することで安全性をモニタリングするシステム)
、VAERS(予防接種後の有害事象を受動的に収集
しモニタリングするシステム)に報告された情報について解析が行われた。米国では当該期間中に約
657,302 人の 5-11 歳の小児がファイザー社のワクチンによる 3 回目の接種を受けた。v-safe の登録者の
うち、1-3 回目の全てをファイザー社ワクチンで接種した 3,249 例が解析された 44(表Ⅲ-2-7)。局所反応
37