よむ、つかう、まなぶ。
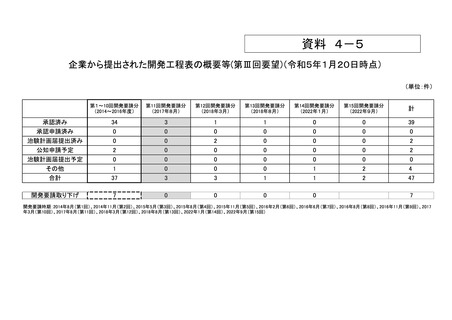
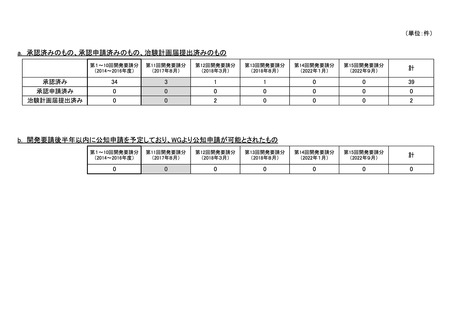
資料4-5 企業から提出された開発工程表の概要等(第III回要望) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
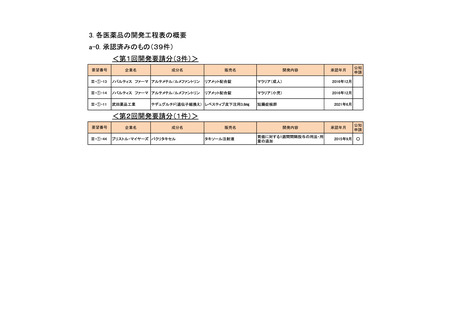
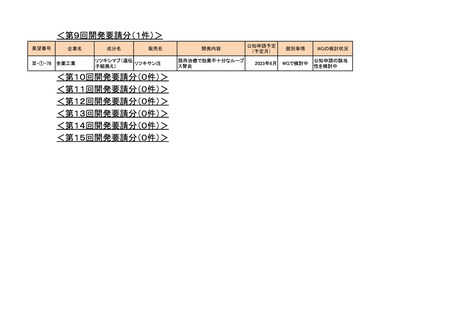
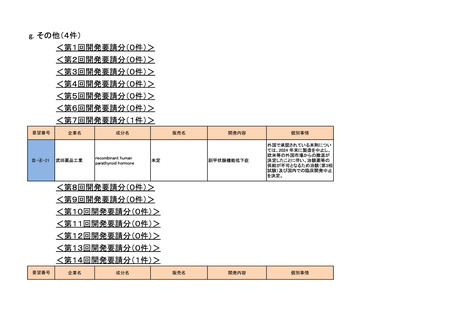
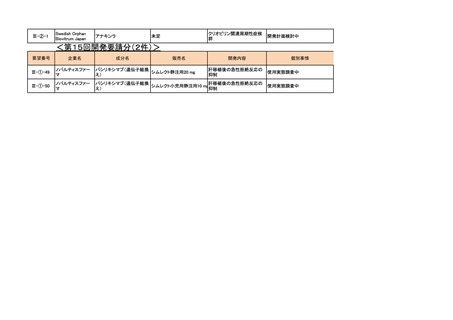
3. 各医薬品の開発工程表の概要
a-0. 承認済みのもの(39件)
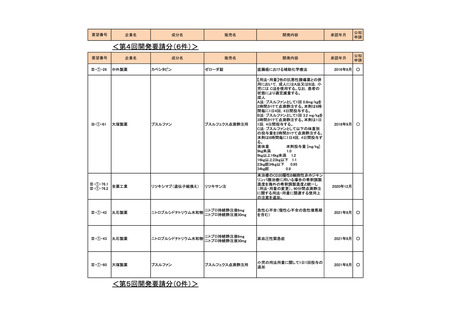
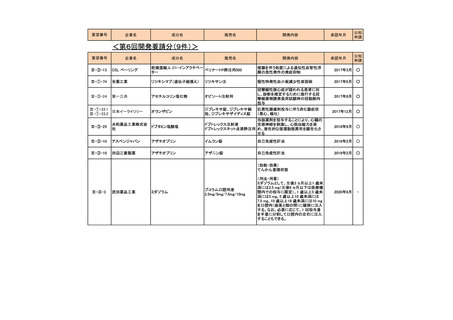
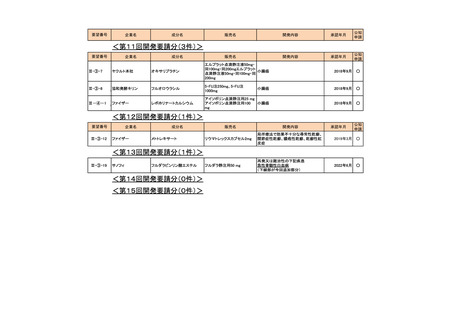
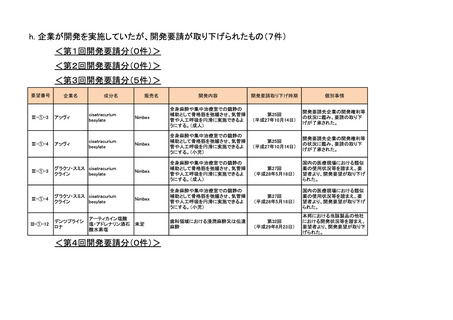
<第1回開発要請分(3件)>
要望番号
企業名
成分名
販売名
開発内容
承認年月
Ⅲ-①-13
ノバルティス ファーマ アルテメテル/ルメファントリン
リアメット配合錠
マラリア(成人)
2016年12月
Ⅲ-①-14
ノバルティス ファーマ アルテメテル/ルメファントリン
リアメット配合錠
マラリア(小児)
2016年12月
Ⅲ-①-11
武田薬品工業
テデュグルチド(遺伝子組換え) レベスティブ皮下注用3.8㎎
短腸症候群
公知
申請
2021年6月
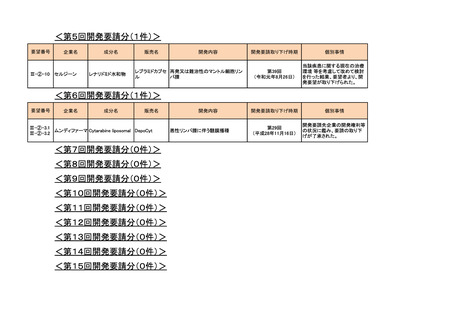
<第2回開発要請分(1件)>
要望番号
Ⅲ-①-44
企業名
成分名
ブリストル・マイヤーズ パクリタキセル
販売名
タキソール注射液
開発内容
胃癌に対する1週間間隔投与の用法・用
量の追加
承認年月
2015年9月
公知
申請
○
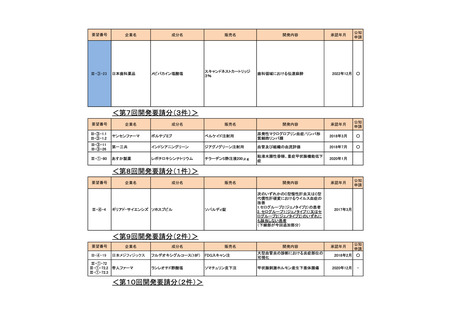
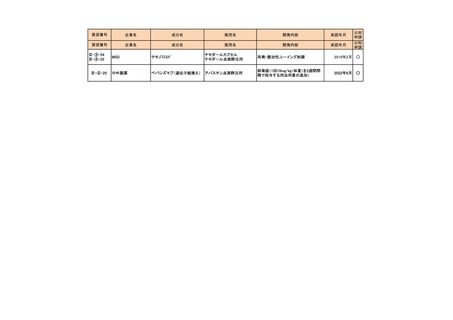
a-0. 承認済みのもの(39件)
<第1回開発要請分(3件)>
要望番号
企業名
成分名
販売名
開発内容
承認年月
Ⅲ-①-13
ノバルティス ファーマ アルテメテル/ルメファントリン
リアメット配合錠
マラリア(成人)
2016年12月
Ⅲ-①-14
ノバルティス ファーマ アルテメテル/ルメファントリン
リアメット配合錠
マラリア(小児)
2016年12月
Ⅲ-①-11
武田薬品工業
テデュグルチド(遺伝子組換え) レベスティブ皮下注用3.8㎎
短腸症候群
公知
申請
2021年6月
<第2回開発要請分(1件)>
要望番号
Ⅲ-①-44
企業名
成分名
ブリストル・マイヤーズ パクリタキセル
販売名
タキソール注射液
開発内容
胃癌に対する1週間間隔投与の用法・用
量の追加
承認年月
2015年9月
公知
申請
○