よむ、つかう、まなぶ。
別紙7 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医 療 技 術 ○有効性の評価結果:
の試験結
果
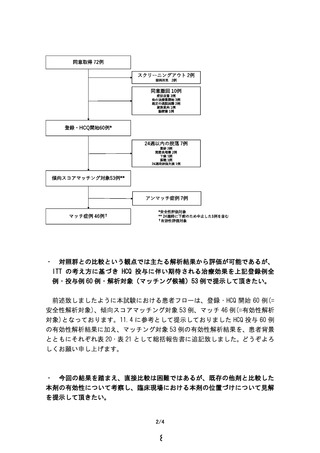
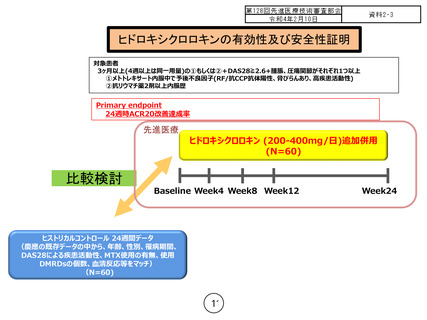
本臨床試験に登録された 60 例(HCQ 群)、及び外部対照となる既存
レジストリに登録された 1649 例から抽出されたマッチング候補 276
例より、傾向スコアマッチングで、HCQ 群およびヒストリカルコント
ール群各 46 例を抽出して比較した。24 週時 ACR20 改善率は、HCQ 群
で 54.4%(25 /46 例、95%CI 39.0-69.1%)、ヒストリカルコントロール
群で 28.3% (13/46 例、95%CI 16.0-43.5%)で、群間差 26.1% [95%CI
8.6-43.6%]、P=0.007(McNemar 検定)と、HCQ 投与群で統計学的有意に
高かった。なお、登録され HCQ が投与開始された HCQ 群全 60 例での
24 週時 ACR20 改善率は 45.0%(27/60 例。ただし、欠測の場合は nonresponder として集計)であった。
○安全性の評価結果:
試験薬内服開始後の有害事象は、60 例中 36 例(60%、95%CI 46.572.4)に 59 件認められた。最多は感染症および寄生虫症で 60 例中 15
例(25%、95%CI 14.7-37.9)に 21 件認められた。うち 11 件はウイルス
性上気道炎、1 件がインフルエンザウイルス A 感染症、3 件が細菌性
肺炎でいずれも非重篤で、外来加療で軽快した。その他感染症として
は泌尿器感染症を 2 件、皮膚感染症を 4 件認めたがいずれも外来加
療で軽快した。次に多いのが胃腸障害で 12 件認められ、下痢 4 件の
うち 2 件は本人希望で HCQ 内服中止となった。筋骨格系および結合
組織障害 9 件のうち 2 件は原病の増悪で、HCQ 効果不十分の判断で試
験を中止し、他治療へ切り替えられた。眼障害は 3 件で、うち内服終
了後の白内障手術 1 件は予定手術が短期入院で行われたため、因果
関係なしの重篤判定となった。クロロキン網膜症の発生は認めなかっ
た。皮膚および皮下組織障害は 3 件で、うち薬疹 2 件は投与中止とな
った。神経系障害は 2 件で、うち 1 件は内服終了後の右頭頂葉皮質下
出血が因果関係なしの重篤判定となった。他に、呼吸器胸郭および縦
隔障害、耳および迷路障害、代謝および栄養障害を各 2 件、腎および
尿路障害、血液およびリンパ系障害、良性、悪性および詳細不明の新
生物を各 1 件認めた。
重篤な有害事象は上記白内障予定手術および右頭頂葉皮質下出血
が認められたが、因果関係なしと判定された。安全性解析対象ではな
いが、試験薬開始前に鼻出血(軽快後 HCQ 投与施行)および脳梗塞(HCQ
投与せず同意撤回)を各 1 件認め、同意取得後のため重篤有害事象と
2
の試験結
果
本臨床試験に登録された 60 例(HCQ 群)、及び外部対照となる既存
レジストリに登録された 1649 例から抽出されたマッチング候補 276
例より、傾向スコアマッチングで、HCQ 群およびヒストリカルコント
ール群各 46 例を抽出して比較した。24 週時 ACR20 改善率は、HCQ 群
で 54.4%(25 /46 例、95%CI 39.0-69.1%)、ヒストリカルコントロール
群で 28.3% (13/46 例、95%CI 16.0-43.5%)で、群間差 26.1% [95%CI
8.6-43.6%]、P=0.007(McNemar 検定)と、HCQ 投与群で統計学的有意に
高かった。なお、登録され HCQ が投与開始された HCQ 群全 60 例での
24 週時 ACR20 改善率は 45.0%(27/60 例。ただし、欠測の場合は nonresponder として集計)であった。
○安全性の評価結果:
試験薬内服開始後の有害事象は、60 例中 36 例(60%、95%CI 46.572.4)に 59 件認められた。最多は感染症および寄生虫症で 60 例中 15
例(25%、95%CI 14.7-37.9)に 21 件認められた。うち 11 件はウイルス
性上気道炎、1 件がインフルエンザウイルス A 感染症、3 件が細菌性
肺炎でいずれも非重篤で、外来加療で軽快した。その他感染症として
は泌尿器感染症を 2 件、皮膚感染症を 4 件認めたがいずれも外来加
療で軽快した。次に多いのが胃腸障害で 12 件認められ、下痢 4 件の
うち 2 件は本人希望で HCQ 内服中止となった。筋骨格系および結合
組織障害 9 件のうち 2 件は原病の増悪で、HCQ 効果不十分の判断で試
験を中止し、他治療へ切り替えられた。眼障害は 3 件で、うち内服終
了後の白内障手術 1 件は予定手術が短期入院で行われたため、因果
関係なしの重篤判定となった。クロロキン網膜症の発生は認めなかっ
た。皮膚および皮下組織障害は 3 件で、うち薬疹 2 件は投与中止とな
った。神経系障害は 2 件で、うち 1 件は内服終了後の右頭頂葉皮質下
出血が因果関係なしの重篤判定となった。他に、呼吸器胸郭および縦
隔障害、耳および迷路障害、代謝および栄養障害を各 2 件、腎および
尿路障害、血液およびリンパ系障害、良性、悪性および詳細不明の新
生物を各 1 件認めた。
重篤な有害事象は上記白内障予定手術および右頭頂葉皮質下出血
が認められたが、因果関係なしと判定された。安全性解析対象ではな
いが、試験薬開始前に鼻出血(軽快後 HCQ 投与施行)および脳梗塞(HCQ
投与せず同意撤回)を各 1 件認め、同意取得後のため重篤有害事象と
2