よむ、つかう、まなぶ。
【参考資料6】国際共同治験に参加する場合の日本人第1相試験の必要性について(第2回検討会 資料1) (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35181.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第3回 9/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
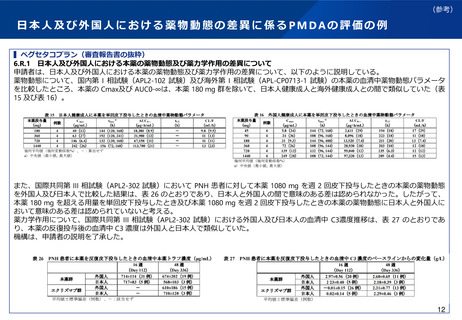
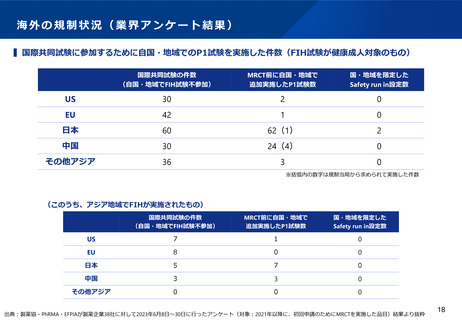
海外の規制状況(業界アンケート結果)
▍海外規制当局の判断の考え方に係る個々の製薬企業の経験
※あくまで個社の経験であり、一般論ではないことに留意が必要
米国
中国
⚫ MRCT(国際共同治験)参加前にUSにおけるP1試験をFDAから求めら
れた事例は無かった。
⚫ 民族差のないことを説明するためにMRCT前に人種差が無いかどうか
PK試験を実施するのが基本であるが、P3試験と並行実施が許容され
るため、PK試験が律速にならない環境である。抗体医薬品に関して
は、MRCT内でのPK取得(PPK解析)により民族差がないことを説明
可能。
⚫ FDAはUSで実施されていないP1試験を受け入れたという具体事例はあ
る。
⚫ MRCTを実施するにあたって、FDAから民族間差に関して問われた経験
はない。(例:抗がん剤領域で、JPでdose-escalation実施後、決定し
た推奨用量でのJP/USのexpansion実施した際に何ら支障なかった)
⚫ 米国では、アジアP1試験がすでに実施されている場合、民族の違いを
考慮して追加の白人のP1試験を必要とせずに、MRCTに参加すること
は可能である。但し、民族の違いが第II相推奨用量の選択に影響を与え
ると予想される場合は、小規模なPK/Safety-run-inが必要になることが
ある(抗がん剤領域)
⚫ 最近の傾向ではCDE当局はMRCTへの早期からの参加を促しており、
特段の安全性の懸念が無い場合はINDが承認されている。一般に、
MRCT参加にあたりアジア人データを提供する、あるいはsafety runinを設定することでMRCTへの参加が承認されるケースが多い。
⚫ 承認済みの自社先行薬剤が存在し、一部改変した薬剤の開発の際、
(中国人を含む)アジア人の先行品の安全性情報では、合意できずに
中国はP1を要求されたため、MRCTに参加できていない。
EU
韓国・台湾
⚫ MRCT参加前に自国/自地域のP1試験を規制当局から求められた事例は
無かった。
⚫ MRCT参加前に自国/自地域のP1試験あるいはSafety-run-inを規制当局
から求められた事例は無かった。
⚫ 基本的にUSと同様の対応で懸案事項が生じたことがない。
⚫ 承認申請時のデータパッケージにおいて民族差評価結果を示すことが
規制要件となっており、民族差は開発過程の中で評価していくものと
いう位置づけである。MRCT前には民族差がないことを説明していな
い。
出典:製薬協・PhRMA・EFPIAが製薬企業38社に対して2023年6月8日~30日に行ったアンケート結果より抜粋
17
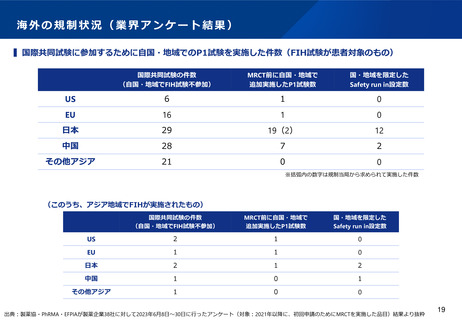
▍海外規制当局の判断の考え方に係る個々の製薬企業の経験
※あくまで個社の経験であり、一般論ではないことに留意が必要
米国
中国
⚫ MRCT(国際共同治験)参加前にUSにおけるP1試験をFDAから求めら
れた事例は無かった。
⚫ 民族差のないことを説明するためにMRCT前に人種差が無いかどうか
PK試験を実施するのが基本であるが、P3試験と並行実施が許容され
るため、PK試験が律速にならない環境である。抗体医薬品に関して
は、MRCT内でのPK取得(PPK解析)により民族差がないことを説明
可能。
⚫ FDAはUSで実施されていないP1試験を受け入れたという具体事例はあ
る。
⚫ MRCTを実施するにあたって、FDAから民族間差に関して問われた経験
はない。(例:抗がん剤領域で、JPでdose-escalation実施後、決定し
た推奨用量でのJP/USのexpansion実施した際に何ら支障なかった)
⚫ 米国では、アジアP1試験がすでに実施されている場合、民族の違いを
考慮して追加の白人のP1試験を必要とせずに、MRCTに参加すること
は可能である。但し、民族の違いが第II相推奨用量の選択に影響を与え
ると予想される場合は、小規模なPK/Safety-run-inが必要になることが
ある(抗がん剤領域)
⚫ 最近の傾向ではCDE当局はMRCTへの早期からの参加を促しており、
特段の安全性の懸念が無い場合はINDが承認されている。一般に、
MRCT参加にあたりアジア人データを提供する、あるいはsafety runinを設定することでMRCTへの参加が承認されるケースが多い。
⚫ 承認済みの自社先行薬剤が存在し、一部改変した薬剤の開発の際、
(中国人を含む)アジア人の先行品の安全性情報では、合意できずに
中国はP1を要求されたため、MRCTに参加できていない。
EU
韓国・台湾
⚫ MRCT参加前に自国/自地域のP1試験を規制当局から求められた事例は
無かった。
⚫ MRCT参加前に自国/自地域のP1試験あるいはSafety-run-inを規制当局
から求められた事例は無かった。
⚫ 基本的にUSと同様の対応で懸案事項が生じたことがない。
⚫ 承認申請時のデータパッケージにおいて民族差評価結果を示すことが
規制要件となっており、民族差は開発過程の中で評価していくものと
いう位置づけである。MRCT前には民族差がないことを説明していな
い。
出典:製薬協・PhRMA・EFPIAが製薬企業38社に対して2023年6月8日~30日に行ったアンケート結果より抜粋
17