よむ、つかう、まなぶ。
【参考資料6】国際共同治験に参加する場合の日本人第1相試験の必要性について(第2回検討会 資料1) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35181.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第3回 9/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
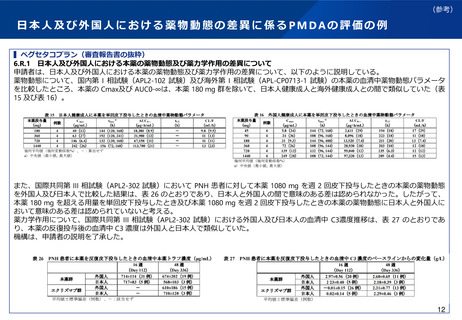
日本人第1相試験の要否に関するこれまでの取り扱い(続き)
▍平成26年事務連絡での例示抜粋
「国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について」(平成26年10月27日付け厚生労働省医薬食品局
審査管理課事務連絡)(抄)
(1)日本人での第Ⅰ相試験が必要と考えられる場合の例
ア 海外での早期臨床試験で重大な安全性の懸念が認められており、その機序等も明確になっておらず、日本人における当該リスク
が外国人と同等あるいはそれ以下であることを示す信頼性のあるデータが得られていない場合
イ 類薬のない新規の有効成分で、海外においても第Ⅰ相反復投与試験の結果が得られていないなど、海外での使用経験は極めて限
られており、日本が参加しようとしている国際共同治験での用法・用量が外国人においても十分な安全性が確保されているとは判断
できない場合
ウ 被験薬の薬物動態特性、海外臨床試験結果、類薬での試験結果等から、日本人における血中濃度又は安全性に係るリスクが外国
人よりも顕著に高いと推測される場合で、国際共同治験で用いる用量を日本人患者に投与した場合の安全性が、外国人での臨床試験
結果から担保されていない場合
(2)日本人での第Ⅰ相試験を実施しないことが許容されうると考えられる場合の例
ア 日本人患者数を考慮すると、大規模比較検証試験や希少疾病を対象とする比較検証試験への速やかな参加を特に考慮すべき場合
で、被験薬について、海外臨床試験で十分な投与経験に基づく安全性が確認されており、得られている知見において民族的要因に民
族間での顕著な差異は認められないと判断できる場合
イ 併用投与の場合で、被験薬及び併用薬で一定の毒性が認められるものの、単独投与における開発医薬品の安全性が日本人で確認
されており、民族的要因に関する既存の知見から、安全性に民族間での顕著な差異は認められないと判断できる場合
ウ 既に日本で承認済みの医薬品の新投与経路、新用量又は新剤形の開発で、既承認医薬品での臨床効果に民族的差異は認められて
おらず、開発対象の投与経路、用量又は剤形での安全性に係るリスクは、既承認医薬品でのリスクと同等以下と考えられる場合
エ バイオ後続品の開発の場合で、適切に実施された品質及び非臨床試験で先行バイオ医薬品との高い類似性が示されており、かつ
先行バイオ医薬品の薬物動態が国内外で類似している場合。なお、バイオ後続品の開発では、日本人を対象とした臨床薬理試験(先
行バイオ医薬品との薬物動態の同等性試験を含む。)が不要な場合もある
6
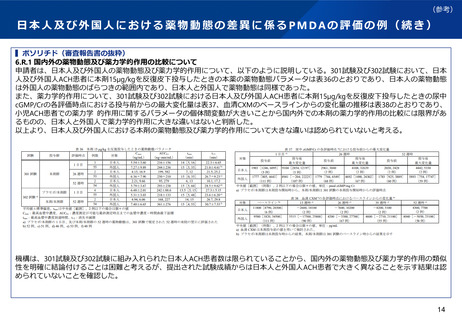
▍平成26年事務連絡での例示抜粋
「国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について」(平成26年10月27日付け厚生労働省医薬食品局
審査管理課事務連絡)(抄)
(1)日本人での第Ⅰ相試験が必要と考えられる場合の例
ア 海外での早期臨床試験で重大な安全性の懸念が認められており、その機序等も明確になっておらず、日本人における当該リスク
が外国人と同等あるいはそれ以下であることを示す信頼性のあるデータが得られていない場合
イ 類薬のない新規の有効成分で、海外においても第Ⅰ相反復投与試験の結果が得られていないなど、海外での使用経験は極めて限
られており、日本が参加しようとしている国際共同治験での用法・用量が外国人においても十分な安全性が確保されているとは判断
できない場合
ウ 被験薬の薬物動態特性、海外臨床試験結果、類薬での試験結果等から、日本人における血中濃度又は安全性に係るリスクが外国
人よりも顕著に高いと推測される場合で、国際共同治験で用いる用量を日本人患者に投与した場合の安全性が、外国人での臨床試験
結果から担保されていない場合
(2)日本人での第Ⅰ相試験を実施しないことが許容されうると考えられる場合の例
ア 日本人患者数を考慮すると、大規模比較検証試験や希少疾病を対象とする比較検証試験への速やかな参加を特に考慮すべき場合
で、被験薬について、海外臨床試験で十分な投与経験に基づく安全性が確認されており、得られている知見において民族的要因に民
族間での顕著な差異は認められないと判断できる場合
イ 併用投与の場合で、被験薬及び併用薬で一定の毒性が認められるものの、単独投与における開発医薬品の安全性が日本人で確認
されており、民族的要因に関する既存の知見から、安全性に民族間での顕著な差異は認められないと判断できる場合
ウ 既に日本で承認済みの医薬品の新投与経路、新用量又は新剤形の開発で、既承認医薬品での臨床効果に民族的差異は認められて
おらず、開発対象の投与経路、用量又は剤形での安全性に係るリスクは、既承認医薬品でのリスクと同等以下と考えられる場合
エ バイオ後続品の開発の場合で、適切に実施された品質及び非臨床試験で先行バイオ医薬品との高い類似性が示されており、かつ
先行バイオ医薬品の薬物動態が国内外で類似している場合。なお、バイオ後続品の開発では、日本人を対象とした臨床薬理試験(先
行バイオ医薬品との薬物動態の同等性試験を含む。)が不要な場合もある
6