よむ、つかう、まなぶ。
【資料4】医薬品等行政評価・監視委員会における海外調査[744KB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
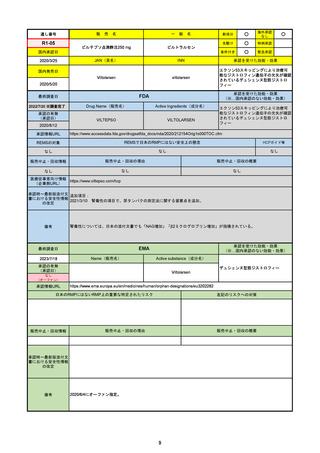
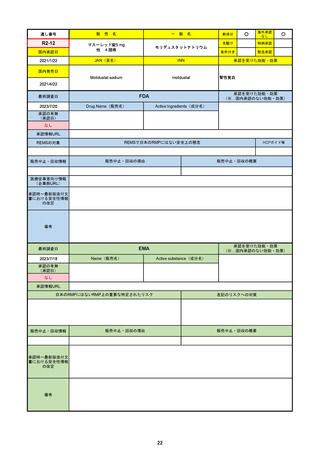
通し番号
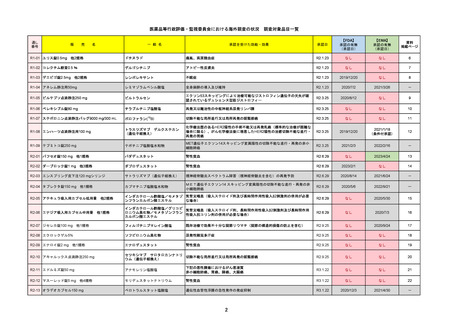
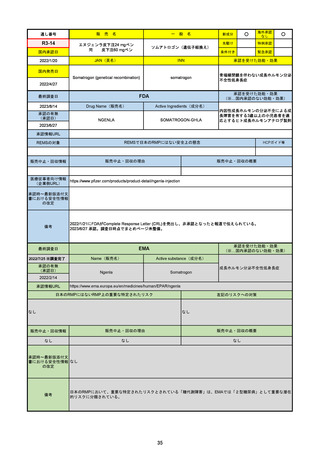
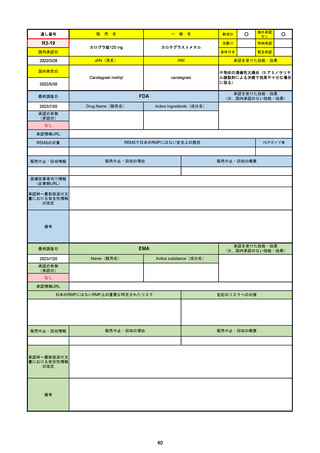
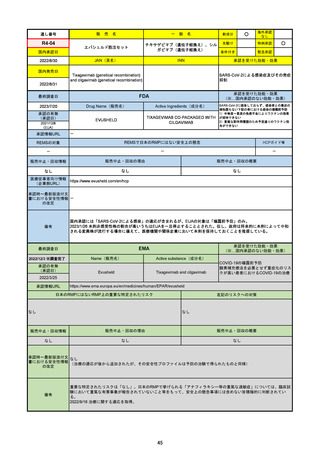
R3-18
販
売
名
一
パキロビッドパック
般
○
海外承認
なし
0
先駆け
0
特例承認
○
条件付き
0
緊急承認
0
ニルマトレルビル/リトナビル
国内承認日
2022/2/10
新成分
名
JAN(英名)
INN
Nirmatrelvir and ritonavir
nirmatrelvir and ritonavir
承認を受けた効能・効果
国内発売日
SARS-CoV-2による感染症
2022/2/14
2023/6/26※調査完了
承認の有無
(承認日)
2021/12/22(EUA)
2023/5/25(正式承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
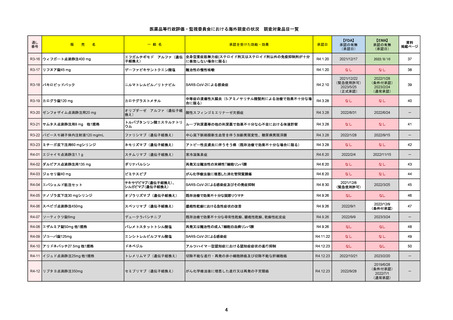
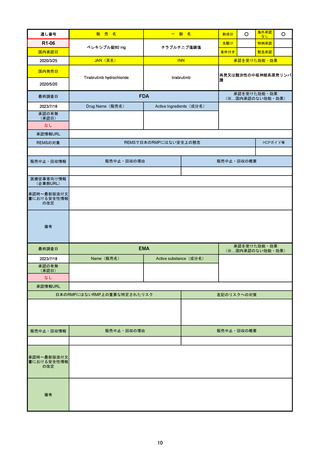
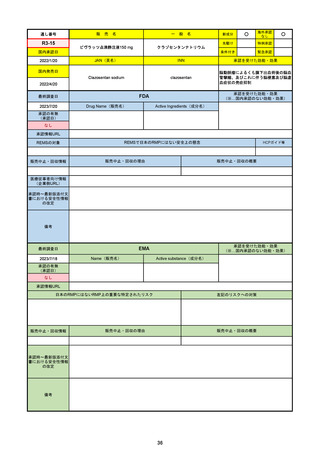
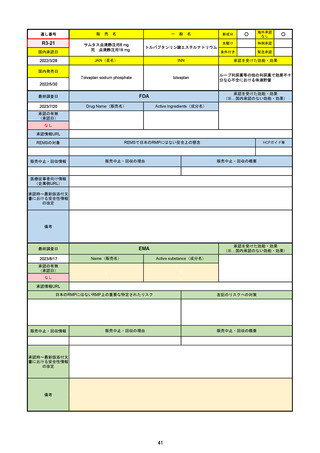
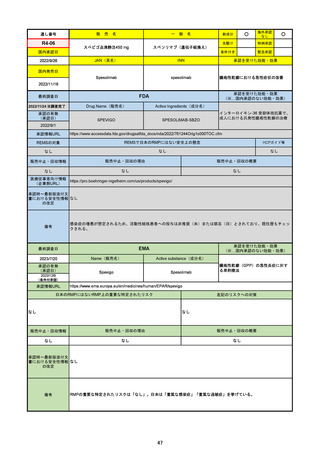
FDA
最終調査日
Drug Name(販売名)
Active Ingredients(成分名)
PAXLOVID
NIRMATRELVIR AND RITONAVIR
入院や死亡など、重度のCOVID-19に進
行するリスクが高い軽症から中等症患者
の治療
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/217188Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
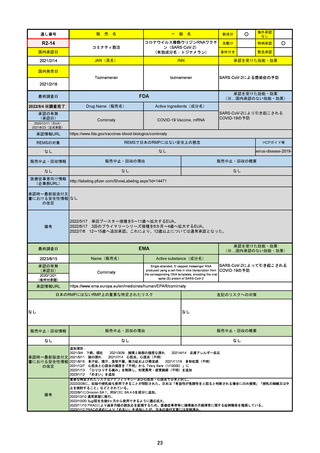
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.fda.gov/media/155071/download
(企業側URL)
承認時~最新版添付文
書における安全性情報 2023/5/25 正式承認。その際、Boxed Warningに、EUAの頃にはなかった薬物相互作用の注意事項が加わった。
の改定
12歳以上かつ体重40kg以上の患者が対象。薬物相互作用のため、クリアランスをCYP3Aに大きく依存し、高濃度が深刻な問題につながる薬物は併
用禁忌。逆に、CYP3Aインデューサーの使用直後の投与も不可。日本の添付文書にも、多数の併用禁忌・併用注意薬物がリストされている。
2022/7/6に薬剤師による処方が許可された。
2023/2に、SARS-CoV-2ウイルス検査の義務付けが解除された。
2023/5/25に正式承認された。薬物相互作用に関するBoxed Warningが追加された。
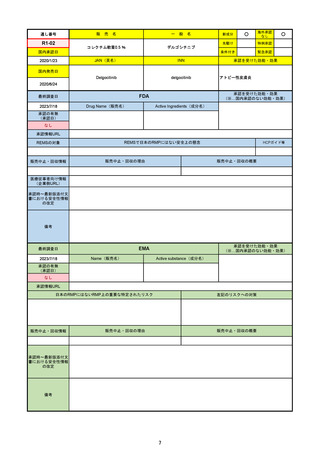
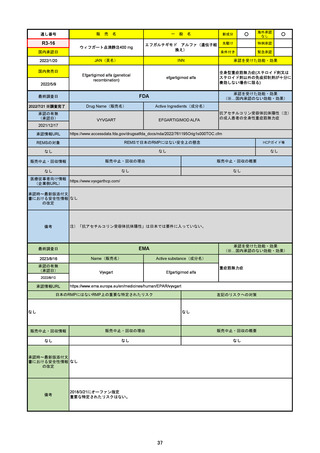
備考
2023/8/17
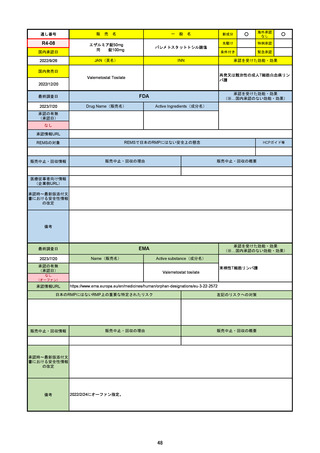
承認の有無
(承認日)
2022/1/28
(条件付承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
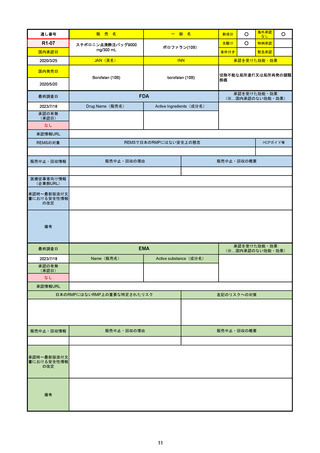
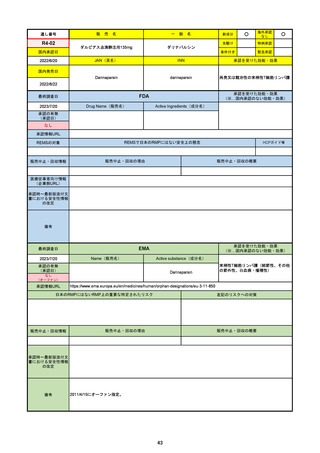
EMA
最終調査日
Name(販売名)
Active substance(成分名)
(1R,2S,5S)-N-((1S)-1-Cyano-2-((3S)-2-oxopyrrolidin-3yl)ethyl)-3-((2S)-3,3-dimethyl-2-(2,2,2-trifluoroacetamido)
butanoyl)-6,6-dimethyl-3-azabicyclo[3.1.0]hexane-2carboxamide
ritonavir
Paxlovid
酸素補給を必要とせず、重度のCOVID19に進行するリスクが高い患者におけ
るCOVID-19の治療
https://www.ema.europa.eu/en/medicines/human/EPAR/paxlovid
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
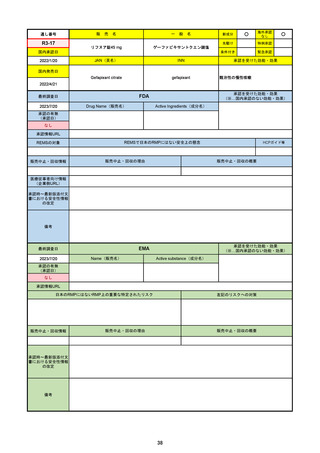
0
0
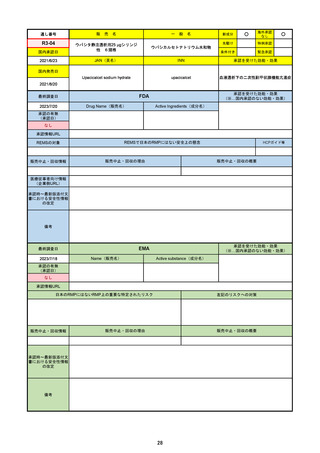
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
承認時~最新版添付文 2022/7/6 ピロキシカムを併用禁忌から除外。
書における安全性情報 2023/4/26 免疫抑制剤との併用に関する警告を記載し、専門家への相談と血中濃度測定を促した。
の改定
2023/6/23 高血圧のリスクを追記。
備考
成人が対象。重要な特定されたリスクはない。
日本ではピロキシカムは併用禁忌のまま。
2023/1/27 CHMPより通常承認の勧告。
2023/2/24 通常承認。
2023/6/23 市販後調査により高血圧のリスクを添付文書に追記。RMPでは対応の必要なしとした。
39
R3-18
販
売
名
一
パキロビッドパック
般
○
海外承認
なし
0
先駆け
0
特例承認
○
条件付き
0
緊急承認
0
ニルマトレルビル/リトナビル
国内承認日
2022/2/10
新成分
名
JAN(英名)
INN
Nirmatrelvir and ritonavir
nirmatrelvir and ritonavir
承認を受けた効能・効果
国内発売日
SARS-CoV-2による感染症
2022/2/14
2023/6/26※調査完了
承認の有無
(承認日)
2021/12/22(EUA)
2023/5/25(正式承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
Drug Name(販売名)
Active Ingredients(成分名)
PAXLOVID
NIRMATRELVIR AND RITONAVIR
入院や死亡など、重度のCOVID-19に進
行するリスクが高い軽症から中等症患者
の治療
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/217188Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
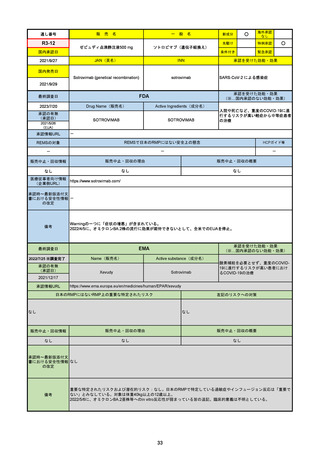
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.fda.gov/media/155071/download
(企業側URL)
承認時~最新版添付文
書における安全性情報 2023/5/25 正式承認。その際、Boxed Warningに、EUAの頃にはなかった薬物相互作用の注意事項が加わった。
の改定
12歳以上かつ体重40kg以上の患者が対象。薬物相互作用のため、クリアランスをCYP3Aに大きく依存し、高濃度が深刻な問題につながる薬物は併
用禁忌。逆に、CYP3Aインデューサーの使用直後の投与も不可。日本の添付文書にも、多数の併用禁忌・併用注意薬物がリストされている。
2022/7/6に薬剤師による処方が許可された。
2023/2に、SARS-CoV-2ウイルス検査の義務付けが解除された。
2023/5/25に正式承認された。薬物相互作用に関するBoxed Warningが追加された。
備考
2023/8/17
承認の有無
(承認日)
2022/1/28
(条件付承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
Name(販売名)
Active substance(成分名)
(1R,2S,5S)-N-((1S)-1-Cyano-2-((3S)-2-oxopyrrolidin-3yl)ethyl)-3-((2S)-3,3-dimethyl-2-(2,2,2-trifluoroacetamido)
butanoyl)-6,6-dimethyl-3-azabicyclo[3.1.0]hexane-2carboxamide
ritonavir
Paxlovid
酸素補給を必要とせず、重度のCOVID19に進行するリスクが高い患者におけ
るCOVID-19の治療
https://www.ema.europa.eu/en/medicines/human/EPAR/paxlovid
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
0
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
承認時~最新版添付文 2022/7/6 ピロキシカムを併用禁忌から除外。
書における安全性情報 2023/4/26 免疫抑制剤との併用に関する警告を記載し、専門家への相談と血中濃度測定を促した。
の改定
2023/6/23 高血圧のリスクを追記。
備考
成人が対象。重要な特定されたリスクはない。
日本ではピロキシカムは併用禁忌のまま。
2023/1/27 CHMPより通常承認の勧告。
2023/2/24 通常承認。
2023/6/23 市販後調査により高血圧のリスクを添付文書に追記。RMPでは対応の必要なしとした。
39