よむ、つかう、まなぶ。
材-1○ 保険医療材料制度の見直しに関する検討(その1)について (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00035.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第122回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
課題・論点
【課題】
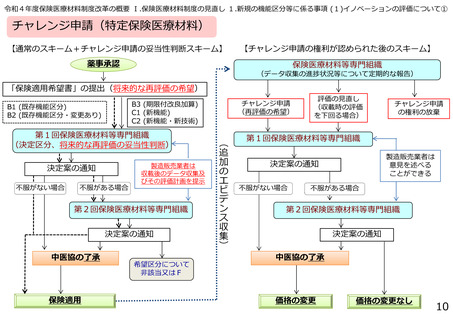
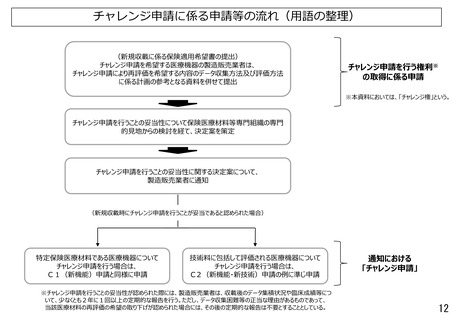
○チャレンジ権を取得する申請の時点について
• チャレンジ申請は、平成30年度診療報酬改定において、有用性の評価に長期間の使用実績が必要なもの等
を評価する観点から導入され、その際、チャレンジ権付与の妥当性の判断は、保険適用希望時に行うものとさ
れた。
• その後令和2年度診療報酬改定において、製造販売業者がチャレンジ申請の権利の付与を希望する場合に
は、付与に係る審議に際して、再評価する内容を明確にするため、収載後のデータ収集及びその評価の計画
を具体的に提示することを求めることとしている。
• チャレンジ権の取得に係る申請について、医療機器業界からは、保険適用の申請時点では追加的な臨床試
験の実施の判断や試験計画の立案が間に合わないことがあること等から、保険適用申請時から一定期間は行
えるようにすべきとの意見があった。
• また、これまでの材料専門部会の議論では、医療機器及び医療機器を用いた技術の再評価においては、医療
機器そのものの評価なのか、技術の評価なのか区別が困難なのではないかとの意見があった。
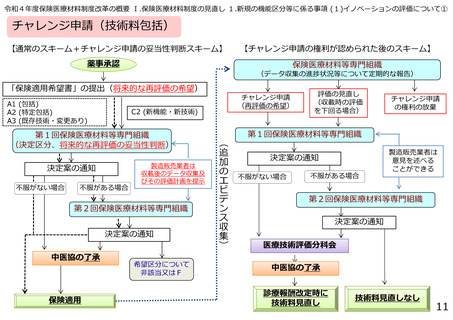
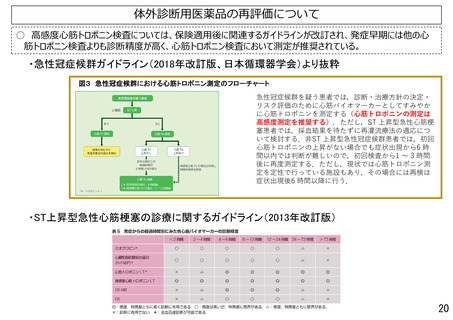
○体外診断用医薬品の再評価について
• 令和4年度診療報酬改定において、保険適用後に有用性が明らかになった医療機器のうち、技術料に包括
して評価されるものがあることを踏まえ、技術料に包括して評価される医療機器についても、チャレンジ申請の対
象となったが、体外診断用医薬品については、チャレンジ申請の対象となっていない。
• 高感度トロポニン検査については、保険適用後に示されたデータより、急性心筋梗塞の診断において従来のト
ロポニン検査よりも発症早期から行えることが示されている。
○チャレンジ権を取得した品目の対応について
• チャレンジ申請を行うことの妥当性が認められた際には、製造販売業者は、収載後のデータ集積状況や臨床
成績等について、少なくとも2年に1回以上の定期的な報告を行うこととされている。ただし、データ収集困難
等の正当な理由があるものであって、当該医療材料の再評価の希望の取り下げが認められた場合には、その
後の定期的な報告は不要とすることとしている。
21
【課題】
○チャレンジ権を取得する申請の時点について
• チャレンジ申請は、平成30年度診療報酬改定において、有用性の評価に長期間の使用実績が必要なもの等
を評価する観点から導入され、その際、チャレンジ権付与の妥当性の判断は、保険適用希望時に行うものとさ
れた。
• その後令和2年度診療報酬改定において、製造販売業者がチャレンジ申請の権利の付与を希望する場合に
は、付与に係る審議に際して、再評価する内容を明確にするため、収載後のデータ収集及びその評価の計画
を具体的に提示することを求めることとしている。
• チャレンジ権の取得に係る申請について、医療機器業界からは、保険適用の申請時点では追加的な臨床試
験の実施の判断や試験計画の立案が間に合わないことがあること等から、保険適用申請時から一定期間は行
えるようにすべきとの意見があった。
• また、これまでの材料専門部会の議論では、医療機器及び医療機器を用いた技術の再評価においては、医療
機器そのものの評価なのか、技術の評価なのか区別が困難なのではないかとの意見があった。
○体外診断用医薬品の再評価について
• 令和4年度診療報酬改定において、保険適用後に有用性が明らかになった医療機器のうち、技術料に包括
して評価されるものがあることを踏まえ、技術料に包括して評価される医療機器についても、チャレンジ申請の対
象となったが、体外診断用医薬品については、チャレンジ申請の対象となっていない。
• 高感度トロポニン検査については、保険適用後に示されたデータより、急性心筋梗塞の診断において従来のト
ロポニン検査よりも発症早期から行えることが示されている。
○チャレンジ権を取得した品目の対応について
• チャレンジ申請を行うことの妥当性が認められた際には、製造販売業者は、収載後のデータ集積状況や臨床
成績等について、少なくとも2年に1回以上の定期的な報告を行うこととされている。ただし、データ収集困難
等の正当な理由があるものであって、当該医療材料の再評価の希望の取り下げが認められた場合には、その
後の定期的な報告は不要とすることとしている。
21