よむ、つかう、まなぶ。
材-1○ 保険医療材料制度の見直しに関する検討(その1)について (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00035.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第122回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
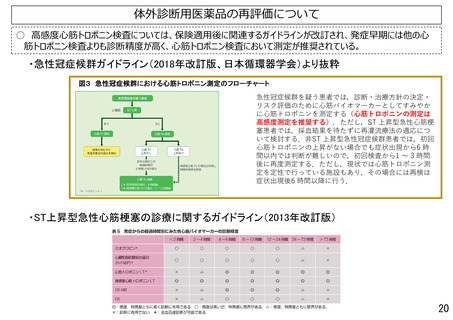
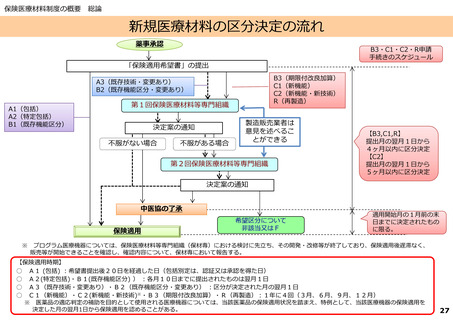
保険医療材料制度の概要 総論
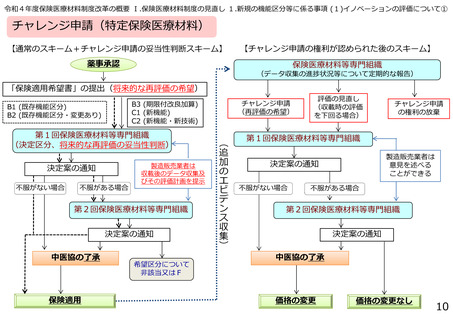
臨床検査(体外診断用医薬品)の区分決定の流れ
薬事承認
「保険適用希望書」の提出
E3(新項目・改良項目)
(新項目・改良項目)
E2(既存項目・変更あり)
(既存項目・変更あり)
第1回保険医療材料等専門組織
E1(既存項目)
区分案の通知
不服がない場合
不服がある場合
製造販売業者は
意見を述べるこ
とができる
提出月の翌月1日か
ら 5ヶ月以内に保
険適用の可否を決定
第2回保険医療材料等専門組織
区分案の通知
中医協の了承
希望区分について非該当
又は保険適用しない
保険適用
【保険適用時期】
E1 (既存項目) :保険適用希望書の受理日から20日を経過した日
E2(既存項目・変更あり):当該区分として保険適用の決定を行った月の翌月1日
E3(新項目、改良項目):当該区分として保険適用の決定を行った月の翌月1日
28
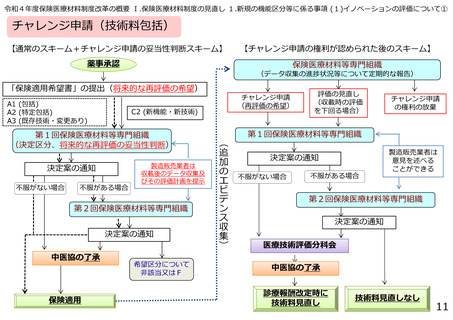
臨床検査(体外診断用医薬品)の区分決定の流れ
薬事承認
「保険適用希望書」の提出
E3(新項目・改良項目)
(新項目・改良項目)
E2(既存項目・変更あり)
(既存項目・変更あり)
第1回保険医療材料等専門組織
E1(既存項目)
区分案の通知
不服がない場合
不服がある場合
製造販売業者は
意見を述べるこ
とができる
提出月の翌月1日か
ら 5ヶ月以内に保
険適用の可否を決定
第2回保険医療材料等専門組織
区分案の通知
中医協の了承
希望区分について非該当
又は保険適用しない
保険適用
【保険適用時期】
E1 (既存項目) :保険適用希望書の受理日から20日を経過した日
E2(既存項目・変更あり):当該区分として保険適用の決定を行った月の翌月1日
E3(新項目、改良項目):当該区分として保険適用の決定を行った月の翌月1日
28