よむ、つかう、まなぶ。
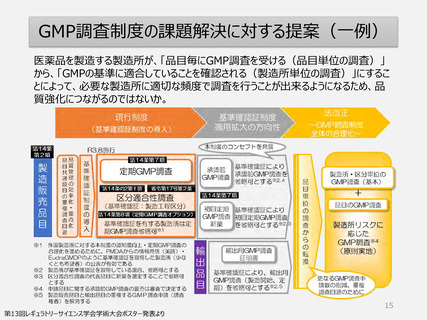
【資料1】柏谷構成員提出資料 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
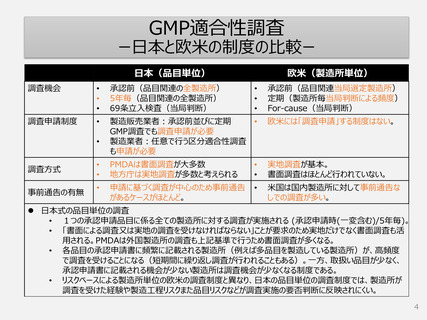
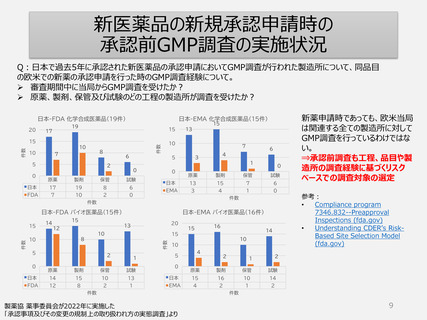
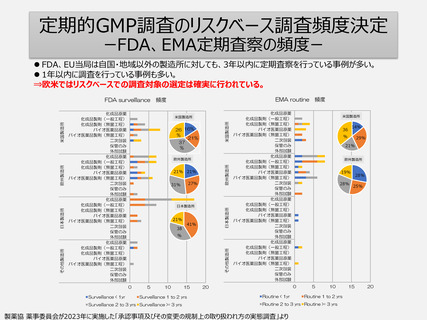
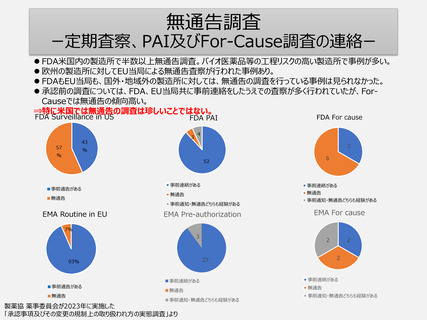
定期的GMP調査のリスクベース調査頻度決定
ーFDA、EMA定期査察の頻度ー
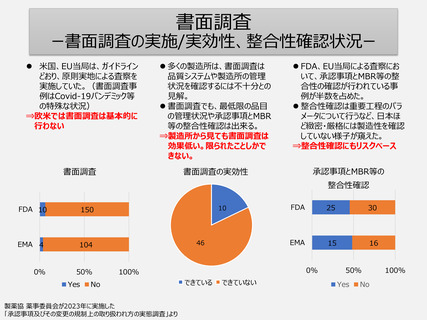
FDA、EU当局は自国・地域以外の製造所に対しても、3年以内に定期査察を行っている事例が多い。
1年以内に調査を行っている事例も多い。
⇒欧米ではリスクベースでの調査対象の選定は確実に行われている。
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
米国製造所
米国製造所
26 16%
%
21%
37
%
欧州製造所
欧州製造所
21% 21%
27%
31%
21%
38
日本製造所
日本製造所
41%
%
0
Surveillance < 1yr
EMA routine 頻度
頻度
その他製造所
その他製造所
日本製造所
欧州製造所
米国製造所
FDA surveillance
5
10
15
Surveillance 1 to 2 yrs
Surveillance 2 to 3 yrs Surveillance >= 3 yrs
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
米国製造所
%
Routine < 1yr
欧州製造所
19%
28%
5
10
Routine 1 to 2 yrs
Routine 2 to 3 yrs Routine >= 3 yrs
製薬協 薬事委員会が2023年に実施した「承認事項及びその変更の規制上の取り扱われ方の実態調査」より
29%
21%
0
20
14%
36
28%
25%
15
20
ーFDA、EMA定期査察の頻度ー
FDA、EU当局は自国・地域以外の製造所に対しても、3年以内に定期査察を行っている事例が多い。
1年以内に調査を行っている事例も多い。
⇒欧米ではリスクベースでの調査対象の選定は確実に行われている。
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
米国製造所
米国製造所
26 16%
%
21%
37
%
欧州製造所
欧州製造所
21% 21%
27%
31%
21%
38
日本製造所
日本製造所
41%
%
0
Surveillance < 1yr
EMA routine 頻度
頻度
その他製造所
その他製造所
日本製造所
欧州製造所
米国製造所
FDA surveillance
5
10
15
Surveillance 1 to 2 yrs
Surveillance 2 to 3 yrs Surveillance >= 3 yrs
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
化成品原薬
化成品製剤(一般工程)
化成品製剤(無菌工程)
バイオ医薬品原薬
バイオ医薬品製剤(無菌工程)
二次包装
保管のみ
外部試験
米国製造所
%
Routine < 1yr
欧州製造所
19%
28%
5
10
Routine 1 to 2 yrs
Routine 2 to 3 yrs Routine >= 3 yrs
製薬協 薬事委員会が2023年に実施した「承認事項及びその変更の規制上の取り扱われ方の実態調査」より
29%
21%
0
20
14%
36
28%
25%
15
20