よむ、つかう、まなぶ。
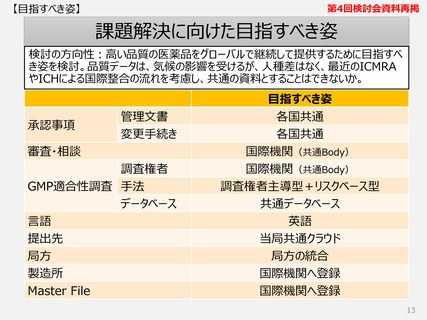
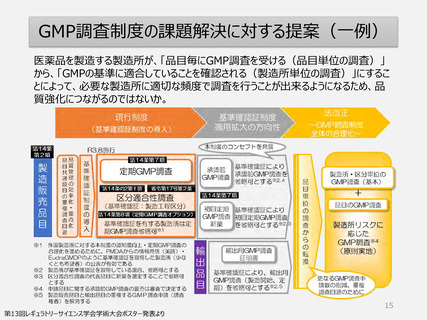
【資料1】柏谷構成員提出資料 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
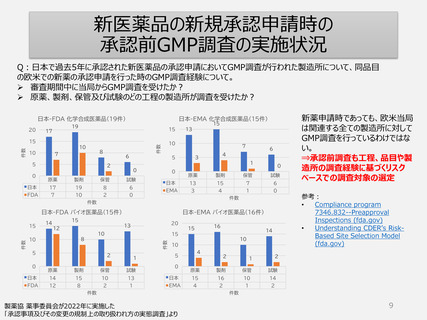
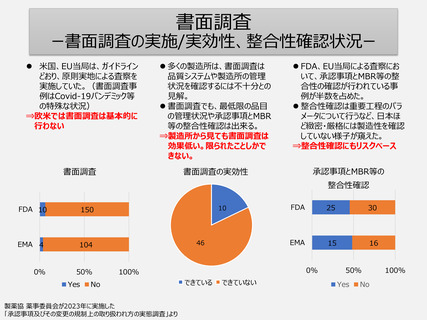
新医薬品の新規承認申請時の
承認前GMP調査の実施状況
Q:日本で過去5年に承認された新医薬品の承認申請においてGMP調査が行われた製造所について、同品目
の欧米での新薬の承認申請を行った時のGMP調査経験について。
審査期間中に当局からGMP調査を受けたか?
原薬、製剤、保管及び試験のどの工程の製造所が調査を受けたか?
日本-FDA 化学合成医薬品(19件)
20
日本-EMA 化学合成医薬品(15件)
15
19
17
15
10
10
8
7
6
5
0
10
件数
件数
15
13
7
3
5
1
2
0
原薬
製剤
保管
試験
日本
17
19
8
6
FDA
7
10
2
0
0
原薬
製剤
保管
試験
13
15
7
6
EMA
3
4
1
0
件数
日本-FDA バイオ医薬品(15件)
日本-EMA バイオ医薬品(16件)
15
14
20
13
12
件数
件数
0
14
15
8
5
16
15
10
10
0
日本
件数
15
6
4
2
1
10
10
4
5
0
2
1
2
原薬
製剤
保管
試験
原薬
製剤
保管
試験
日本
14
15
10
13
日本
15
16
10
14
FDA
12
8
2
1
EMA
4
2
1
2
件数
製薬協 薬事委員会が2022年に実施した
「承認事項及びその変更の規制上の取り扱われ方の実態調査」より
新薬申請時であっても、欧米当局
は関連する全ての製造所に対して
GMP調査を行っているわけではな
い。
⇒承認前調査も工程、品目や製
造所の調査経験に基づくリスク
ベースでの調査対象の選定
参考:
•
Compliance program
7346.832--Preapproval
Inspections (fda.gov)
•
Understanding CDER’s RiskBased Site Selection Model
(fda.gov)
件数
9
承認前GMP調査の実施状況
Q:日本で過去5年に承認された新医薬品の承認申請においてGMP調査が行われた製造所について、同品目
の欧米での新薬の承認申請を行った時のGMP調査経験について。
審査期間中に当局からGMP調査を受けたか?
原薬、製剤、保管及び試験のどの工程の製造所が調査を受けたか?
日本-FDA 化学合成医薬品(19件)
20
日本-EMA 化学合成医薬品(15件)
15
19
17
15
10
10
8
7
6
5
0
10
件数
件数
15
13
7
3
5
1
2
0
原薬
製剤
保管
試験
日本
17
19
8
6
FDA
7
10
2
0
0
原薬
製剤
保管
試験
13
15
7
6
EMA
3
4
1
0
件数
日本-FDA バイオ医薬品(15件)
日本-EMA バイオ医薬品(16件)
15
14
20
13
12
件数
件数
0
14
15
8
5
16
15
10
10
0
日本
件数
15
6
4
2
1
10
10
4
5
0
2
1
2
原薬
製剤
保管
試験
原薬
製剤
保管
試験
日本
14
15
10
13
日本
15
16
10
14
FDA
12
8
2
1
EMA
4
2
1
2
件数
製薬協 薬事委員会が2022年に実施した
「承認事項及びその変更の規制上の取り扱われ方の実態調査」より
新薬申請時であっても、欧米当局
は関連する全ての製造所に対して
GMP調査を行っているわけではな
い。
⇒承認前調査も工程、品目や製
造所の調査経験に基づくリスク
ベースでの調査対象の選定
参考:
•
Compliance program
7346.832--Preapproval
Inspections (fda.gov)
•
Understanding CDER’s RiskBased Site Selection Model
(fda.gov)
件数
9