よむ、つかう、まなぶ。
【資料1】柏谷構成員提出資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【背景】
第4回検討会資料一部改編
サプライチェーンのグローバル化
販売地域
製剤製造
原薬・中間体
第13回レギュラトリーサイエンス学会学術大会:眞鍋淳氏 特別講演の資料より
•
2002年薬事法改正以降、日本に供給される原薬、製剤の製造は、内資/外資、先発/後
発ともに委託化が進み、医薬品製造はグローバルへ展開
•
各製造所の設備を用いて製造される製品の製造方法は一つ。出来上がる製品も一つ。
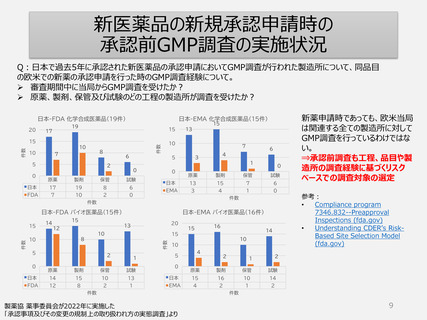
日本では承認取得には、その物の製造所は国内外問わず全てGMP調査を受けなけれ
ばならず、また承認後5年毎に調査を受けなければならないと薬機法で規定。
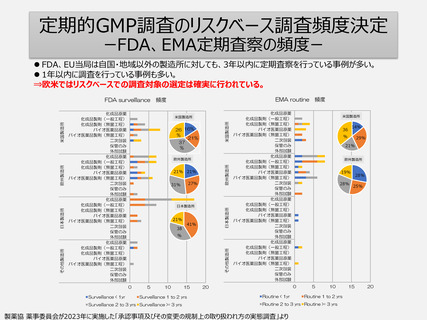
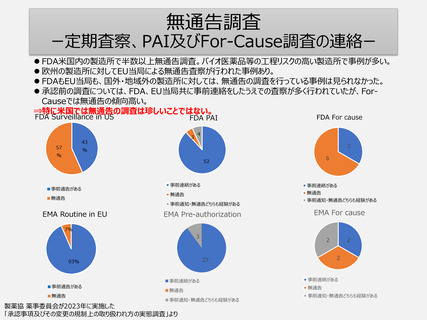
PIC/S等によりGMP基準・調査手法は世界共通化の方向へ。
3
第4回検討会資料一部改編
サプライチェーンのグローバル化
販売地域
製剤製造
原薬・中間体
第13回レギュラトリーサイエンス学会学術大会:眞鍋淳氏 特別講演の資料より
•
2002年薬事法改正以降、日本に供給される原薬、製剤の製造は、内資/外資、先発/後
発ともに委託化が進み、医薬品製造はグローバルへ展開
•
各製造所の設備を用いて製造される製品の製造方法は一つ。出来上がる製品も一つ。
日本では承認取得には、その物の製造所は国内外問わず全てGMP調査を受けなけれ
ばならず、また承認後5年毎に調査を受けなければならないと薬機法で規定。
PIC/S等によりGMP基準・調査手法は世界共通化の方向へ。
3