よむ、つかう、まなぶ。
【資料1】柏谷構成員提出資料 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
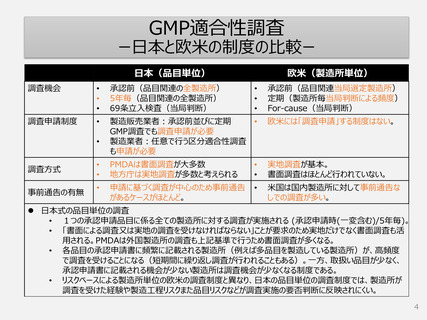
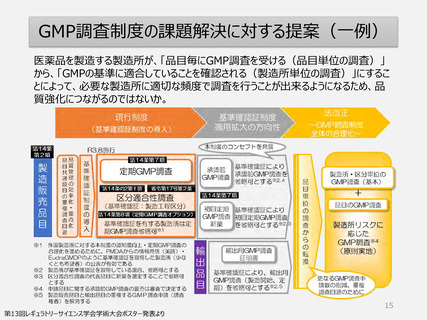
GMP適合性調査
ー日本と欧米の制度の比較ー
日本(品目単位)
欧米(製造所単位)
調査機会
•
•
•
承認前(品目関連の全製造所)
5年毎(品目関連の全製造所)
69条立入検査(当局判断)
調査申請制度
•
製造販売業者:承認前並びに定期
•
GMP調査でも調査申請が必要
製造業者:任意で行う区分適合性調査
も申請が必要
欧米には「調査申請」する制度はない。
•
•
•
•
承認前(品目関連当局選定製造所)
定期(製造所毎当局判断による頻度)
For-cause(当局判断)
調査方式
•
•
PMDAは書面調査が大多数
地方庁は実地調査が多数と考えられる
•
•
実地調査が基本。
書面調査はほとんど行われていない。
事前通告の有無
•
申請に基づく調査が中心のため事前通告
があるケースがほとんど。
•
米国は国内製造所に対して事前通告な
しでの調査が多い。
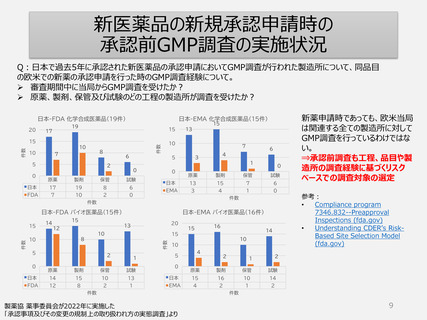
日本式の品目単位の調査
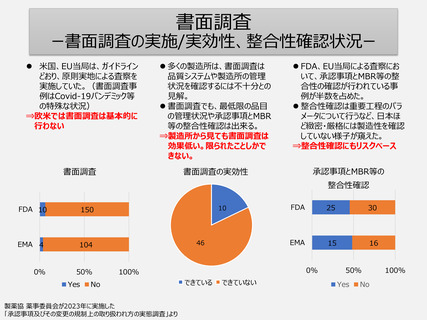
• 1つの承認申請品目に係る全ての製造所に対する調査が実施される (承認申請時(一変含む)/5年毎)。
• 「書面による調査又は実地の調査を受けなければならない」ことが要求のため実地だけでなく書面調査も活
用される。PMDAは外国製造所の調査も上記基準で行うため書面調査が多くなる。
• 各品目の承認申請書に頻繁に記載される製造所(例えば多品目を製造している製造所)が、高頻度
で調査を受けることになる(短期間に繰り返し調査が行われることもある)。一方、取扱い品目が少なく、
承認申請書に記載される機会が少ない製造所は調査機会が少なくなる制度である。
• リスクベースによる製造所単位の欧米の調査制度と異なり、日本の品目単位の調査制度では、製造所が
調査を受けた経験や製造工程リスクまた品目リスクなどが調査実施の要否判断に反映されにくい。
4
ー日本と欧米の制度の比較ー
日本(品目単位)
欧米(製造所単位)
調査機会
•
•
•
承認前(品目関連の全製造所)
5年毎(品目関連の全製造所)
69条立入検査(当局判断)
調査申請制度
•
製造販売業者:承認前並びに定期
•
GMP調査でも調査申請が必要
製造業者:任意で行う区分適合性調査
も申請が必要
欧米には「調査申請」する制度はない。
•
•
•
•
承認前(品目関連当局選定製造所)
定期(製造所毎当局判断による頻度)
For-cause(当局判断)
調査方式
•
•
PMDAは書面調査が大多数
地方庁は実地調査が多数と考えられる
•
•
実地調査が基本。
書面調査はほとんど行われていない。
事前通告の有無
•
申請に基づく調査が中心のため事前通告
があるケースがほとんど。
•
米国は国内製造所に対して事前通告な
しでの調査が多い。
日本式の品目単位の調査
• 1つの承認申請品目に係る全ての製造所に対する調査が実施される (承認申請時(一変含む)/5年毎)。
• 「書面による調査又は実地の調査を受けなければならない」ことが要求のため実地だけでなく書面調査も活
用される。PMDAは外国製造所の調査も上記基準で行うため書面調査が多くなる。
• 各品目の承認申請書に頻繁に記載される製造所(例えば多品目を製造している製造所)が、高頻度
で調査を受けることになる(短期間に繰り返し調査が行われることもある)。一方、取扱い品目が少なく、
承認申請書に記載される機会が少ない製造所は調査機会が少なくなる制度である。
• リスクベースによる製造所単位の欧米の調査制度と異なり、日本の品目単位の調査制度では、製造所が
調査を受けた経験や製造工程リスクまた品目リスクなどが調査実施の要否判断に反映されにくい。
4