よむ、つかう、まなぶ。
【資料1】柏谷構成員提出資料 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
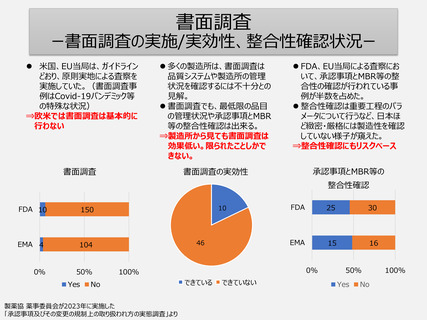
【日本でできること】
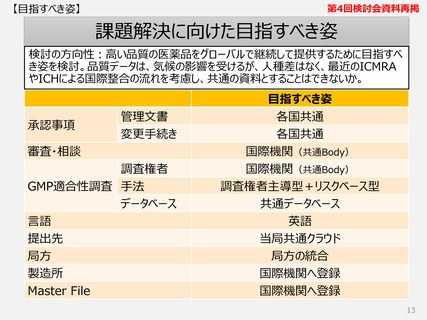
第4回検討会資料再掲
本検討会において議論したい
課題に対する解決の方向性
1.
2.
3.
製造方法(規格及び試験方法等を含む)を変更する手続き制度
欧米を参考に3段階様の変更手続き制度の導入
届出後短期間で手続区分及び変更内容の妥当性が確認される制度へ
承認時に将来の変更手続き区分を決めるのではなく、欧米と同様に蓄積された
製造実績や知識に拠るリスクベースの考え方を取り入れた変更時に手続き区分
が選択できる仕組みの導入
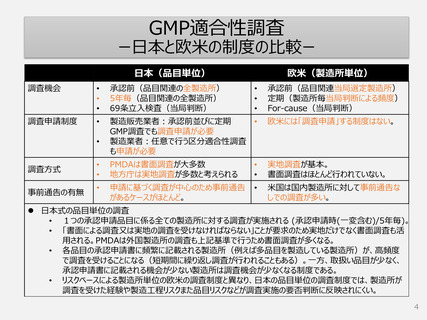
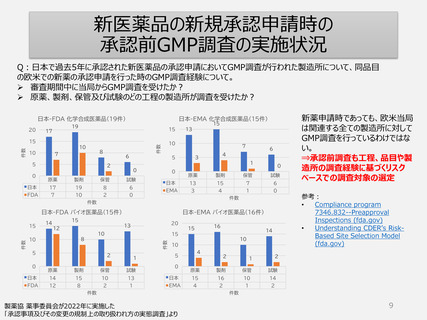
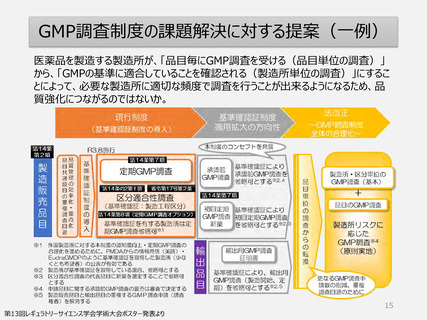
GMP適合性調査制度
承認申請時(一変申請を含む)は調査要否を当局がリスク(製造所、品目や製造工程
等)に基づいて判断し決定した製造所を調査する方式へ
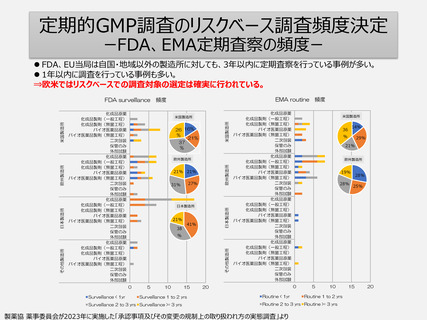
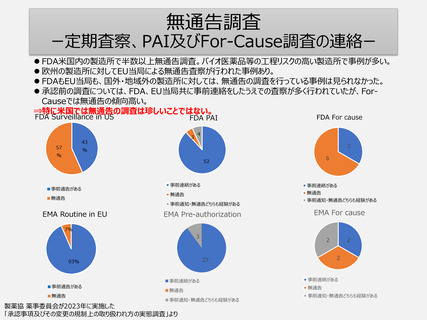
5年毎の定期調査を廃止し、製造所のリスクに応じた頻度で実地による調査へ
品目の承認申請や変更手続きのタイムラインへ影響しない製造所単位の調査
制度へ
局方
欧米局方(USP、Ph.Eur.)を日局と同等の局方として受入れ
障壁となり得る他国との法・制度の違いを解消
更なる品質確保のための制度を総合的に整理
2
第4回検討会資料再掲
本検討会において議論したい
課題に対する解決の方向性
1.
2.
3.
製造方法(規格及び試験方法等を含む)を変更する手続き制度
欧米を参考に3段階様の変更手続き制度の導入
届出後短期間で手続区分及び変更内容の妥当性が確認される制度へ
承認時に将来の変更手続き区分を決めるのではなく、欧米と同様に蓄積された
製造実績や知識に拠るリスクベースの考え方を取り入れた変更時に手続き区分
が選択できる仕組みの導入
GMP適合性調査制度
承認申請時(一変申請を含む)は調査要否を当局がリスク(製造所、品目や製造工程
等)に基づいて判断し決定した製造所を調査する方式へ
5年毎の定期調査を廃止し、製造所のリスクに応じた頻度で実地による調査へ
品目の承認申請や変更手続きのタイムラインへ影響しない製造所単位の調査
制度へ
局方
欧米局方(USP、Ph.Eur.)を日局と同等の局方として受入れ
障壁となり得る他国との法・制度の違いを解消
更なる品質確保のための制度を総合的に整理
2