よむ、つかう、まなぶ。
【資料1-2】認証基準改正案 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37966.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第7回 2/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
汎用針付注射筒に関する取扱い(案)
(1)適用範囲
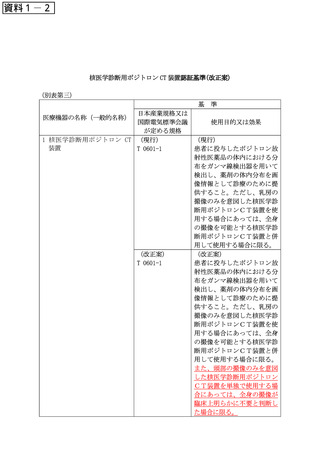
告示別表第2の XXX に規定する「汎用針付注射筒」は、医薬品、医療機器
等の品質、有効性及び安全性の確保等に関する法律第2条第5項から第7項
までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機器
及び一般医療機器(平成 16 年厚生労働省告示第 298 号)別表第2第 640 号に
規定する汎用針付注射筒とする。
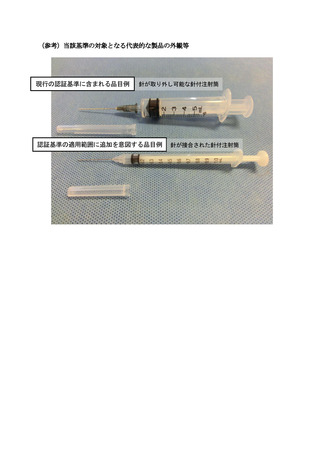
上記「汎用針付注射筒」は、針管を注射筒へ接合したものも含まれる。
上記「汎用針付注射筒」に含まれる針は、公称外径 0.18 mm~1.2 mm の注
射針に限り、歯科用針及びペン形針は除く。
なお、上記「汎用針付注射筒」に含まれる注射筒は、針付き又は針無しの、
プラスチック又はその他の材料で作られた滅菌済み注射筒に限る。充填後す
ぐに使用することを意図しており、長期間にわたって薬剤を収容するものは
除く。インスリン皮下投与用注射筒、ガラス製単回使用注射筒、シリンジポ
ンプ用注射筒、あらかじめ薬剤が充填された注射筒、及び充填後保管するこ
とを意図した注射筒は、認証基準の適用範囲外とする。
(2)既存品目との同等性を評価すべき主要評価項目とその基準
以下に示す内容を踏まえ、既存品との同等性評価を行うこと。その際には、
既存品に適用される規格等((3)基本要件基準を満たすために引用可能な規
格等一覧を参照)を用いること。
① 材質並びに形状及び構造
(ア) 針管の材料
針管の材料は、JIS T 3209:2022「滅菌済み注射針」の「4.10.1
一般」を満たしていることを評価する。
(イ) 潤滑剤
注射針及び注射筒の潤滑剤は、厚生労働省が定めたシリコーン油基
準又はこれと同等以上の基準(例えば、ヨーロッパ薬局方(EP))に
適合するものでなければならない。
注射針の潤滑剤の量は、JIS T 3209:2022「滅菌済み注射針」の「4
.10.4 潤滑剤」を満たしていることを評価する。
注射筒の潤滑剤の量は、JIS T 3210:2022「滅菌済み注射筒」の「7
.2 潤滑剤の量」を満たしていることを評価する。
6 / 11
(1)適用範囲
告示別表第2の XXX に規定する「汎用針付注射筒」は、医薬品、医療機器
等の品質、有効性及び安全性の確保等に関する法律第2条第5項から第7項
までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機器
及び一般医療機器(平成 16 年厚生労働省告示第 298 号)別表第2第 640 号に
規定する汎用針付注射筒とする。
上記「汎用針付注射筒」は、針管を注射筒へ接合したものも含まれる。
上記「汎用針付注射筒」に含まれる針は、公称外径 0.18 mm~1.2 mm の注
射針に限り、歯科用針及びペン形針は除く。
なお、上記「汎用針付注射筒」に含まれる注射筒は、針付き又は針無しの、
プラスチック又はその他の材料で作られた滅菌済み注射筒に限る。充填後す
ぐに使用することを意図しており、長期間にわたって薬剤を収容するものは
除く。インスリン皮下投与用注射筒、ガラス製単回使用注射筒、シリンジポ
ンプ用注射筒、あらかじめ薬剤が充填された注射筒、及び充填後保管するこ
とを意図した注射筒は、認証基準の適用範囲外とする。
(2)既存品目との同等性を評価すべき主要評価項目とその基準
以下に示す内容を踏まえ、既存品との同等性評価を行うこと。その際には、
既存品に適用される規格等((3)基本要件基準を満たすために引用可能な規
格等一覧を参照)を用いること。
① 材質並びに形状及び構造
(ア) 針管の材料
針管の材料は、JIS T 3209:2022「滅菌済み注射針」の「4.10.1
一般」を満たしていることを評価する。
(イ) 潤滑剤
注射針及び注射筒の潤滑剤は、厚生労働省が定めたシリコーン油基
準又はこれと同等以上の基準(例えば、ヨーロッパ薬局方(EP))に
適合するものでなければならない。
注射針の潤滑剤の量は、JIS T 3209:2022「滅菌済み注射針」の「4
.10.4 潤滑剤」を満たしていることを評価する。
注射筒の潤滑剤の量は、JIS T 3210:2022「滅菌済み注射筒」の「7
.2 潤滑剤の量」を満たしていることを評価する。
6 / 11