よむ、つかう、まなぶ。
【資料54-2】研究開発段階に係る第二種使用等の大臣確認制度の見直しについて (14 ページ)
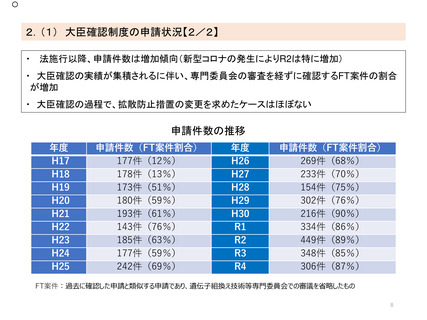
出典
| 公開元URL | https://www.mext.go.jp/b_menu/shingi/gijyutu/gijyutu1/mext_00002.html |
| 出典情報 | 科学技術・学術審議会 生命倫理・安全部会(第54回 3/14)《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考)EUにおける遺伝子組換え実験に関する規制
✓ 遺伝子組換え微生物の閉鎖系使用のための共通措置として、Directive 2009/41/EC(遺伝子
組換え微生物の閉鎖系使用に関する欧州議会及び理事会指令)を制定
✓ Directive 2009/41/ECにおいては、人の健康と環境の保護を目的とし、遺伝子組換え微生物
の閉鎖系使用に関する一般的な措置を規定。EU加盟国においては、それぞれの国の法制度
によってこの指令を実行
•
•
研究者は、 遺伝子組換え微生物の閉鎖系使用にあたり、事前にリスク評価を実施し、封
じ込め措置のレベルについて検討
遺伝子組換え微生物の閉鎖系使用にあたり、必要となる手続は以下のとおり
1.施設登録
初めて遺伝子組換え微生物を閉鎖系使用する施設の場合、使用開始前に当該施設に
係る情報を規制当局に登録。
2.研究実施申請
遺伝子組換え微生物の封じ込めレベルに応じ必要な手続は以下のとおり
•
封じ込めレベル1:施設登録後すぐに研究実施可能、研究実施毎の手続は不要
•
封じ込めレベル2:施設登録に加え、研究実施毎に研究の詳細情報及びそのリスク
評価結果を事前届出
(初回届出時は届出後45日経過後、2回目以降は届出後すぐ研究実施可能)
• 封じ込めレベル3,4:施設登録に加え、研究実施毎に研究の詳細情報及びリスク評価
結果を事前申請、規制当局からの許可後、研究実施可能
14
✓ 遺伝子組換え微生物の閉鎖系使用のための共通措置として、Directive 2009/41/EC(遺伝子
組換え微生物の閉鎖系使用に関する欧州議会及び理事会指令)を制定
✓ Directive 2009/41/ECにおいては、人の健康と環境の保護を目的とし、遺伝子組換え微生物
の閉鎖系使用に関する一般的な措置を規定。EU加盟国においては、それぞれの国の法制度
によってこの指令を実行
•
•
研究者は、 遺伝子組換え微生物の閉鎖系使用にあたり、事前にリスク評価を実施し、封
じ込め措置のレベルについて検討
遺伝子組換え微生物の閉鎖系使用にあたり、必要となる手続は以下のとおり
1.施設登録
初めて遺伝子組換え微生物を閉鎖系使用する施設の場合、使用開始前に当該施設に
係る情報を規制当局に登録。
2.研究実施申請
遺伝子組換え微生物の封じ込めレベルに応じ必要な手続は以下のとおり
•
封じ込めレベル1:施設登録後すぐに研究実施可能、研究実施毎の手続は不要
•
封じ込めレベル2:施設登録に加え、研究実施毎に研究の詳細情報及びそのリスク
評価結果を事前届出
(初回届出時は届出後45日経過後、2回目以降は届出後すぐ研究実施可能)
• 封じ込めレベル3,4:施設登録に加え、研究実施毎に研究の詳細情報及びリスク評価
結果を事前申請、規制当局からの許可後、研究実施可能
14