よむ、つかう、まなぶ。
【参考資料5】後発品の安定供給に関連する情報の公表等に関するガイドライン(令和6年3月29日) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39824.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第12回 4/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
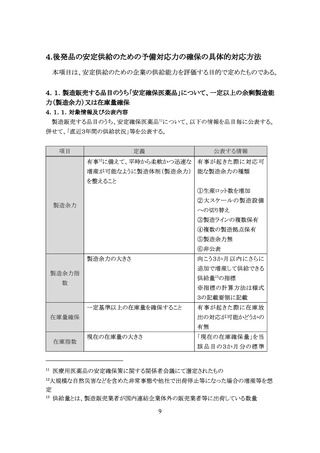
2.各品目の製造等に関する情報
本項目は、製造販売する品目について複数銘柄が同一製造所で製造されている
場合の透明性等を評価する目的で定めたものである。
2.1.製造販売する品目の製造業者名
製造販売する品目毎に、医薬品、医療機器等の品質、有効性及び安全性の確保等に関す
る法律(以下「医薬品医療機器等法」という。)第 13 条第2項に規定する同法施行規則第 25
条第1号から第4号に該当する許可の区分を有する医薬品の製造業者(原薬3のみ製造する
製造業者を除く)の名称を公表する。併せて、製造販売する品目数及び製造販売する医薬品
毎に「薬剤区分」、「薬価基準収載医薬品コード」、「YJ コード」、「製造販売業者」、「品名」、
「規格」等を公表する。
また、製造委託する医薬品の割合を可視化する観点から、自社が製造販売する後発品・そ
の他品目のうち、自社で製造する品目の割合を公表することが望ましい。(任意の公表事項)
2.2.製造販売する品目の原薬に係る製造国及び複数の購買先
製造販売する品目毎に、当該医薬品の原薬について、製造施設が属する製造国を公表す
る。
輸入により粗原薬4を入手し、国内で最終精製工程を実施している原薬については、粗原薬
の製造国と最終精製工程を実施した国を併記する。
また、サプライチェーン強靱化の観点から、複数の原薬購買先を設定することが求められて
いる5ため、自社が製造販売する後発品・その他品目のうち、原薬を複数購買している品目数
の割合を公表する。
3
原薬とは、化学合成、発酵若しくは抽出など又はこれらの操作の組み合わせによつて製造さ
れ、最終製品の段階において薬理作用を有する物質(有効成分)であつて、医薬品の製造原
料となるものをいう。(昭和六三年七月十五日付薬発五九八号厚生省薬務局長通知)
4
粗原薬とは、精製前の化合物を指す。
5
後発医薬品のさらなる使用促進のためのロードマップ(平成 25 年4月5日公表)にて、後発
品メーカーが行うべき取組の一つとして、原薬の状況に応じたダブルソース化が求められた。
6
本項目は、製造販売する品目について複数銘柄が同一製造所で製造されている
場合の透明性等を評価する目的で定めたものである。
2.1.製造販売する品目の製造業者名
製造販売する品目毎に、医薬品、医療機器等の品質、有効性及び安全性の確保等に関す
る法律(以下「医薬品医療機器等法」という。)第 13 条第2項に規定する同法施行規則第 25
条第1号から第4号に該当する許可の区分を有する医薬品の製造業者(原薬3のみ製造する
製造業者を除く)の名称を公表する。併せて、製造販売する品目数及び製造販売する医薬品
毎に「薬剤区分」、「薬価基準収載医薬品コード」、「YJ コード」、「製造販売業者」、「品名」、
「規格」等を公表する。
また、製造委託する医薬品の割合を可視化する観点から、自社が製造販売する後発品・そ
の他品目のうち、自社で製造する品目の割合を公表することが望ましい。(任意の公表事項)
2.2.製造販売する品目の原薬に係る製造国及び複数の購買先
製造販売する品目毎に、当該医薬品の原薬について、製造施設が属する製造国を公表す
る。
輸入により粗原薬4を入手し、国内で最終精製工程を実施している原薬については、粗原薬
の製造国と最終精製工程を実施した国を併記する。
また、サプライチェーン強靱化の観点から、複数の原薬購買先を設定することが求められて
いる5ため、自社が製造販売する後発品・その他品目のうち、原薬を複数購買している品目数
の割合を公表する。
3
原薬とは、化学合成、発酵若しくは抽出など又はこれらの操作の組み合わせによつて製造さ
れ、最終製品の段階において薬理作用を有する物質(有効成分)であつて、医薬品の製造原
料となるものをいう。(昭和六三年七月十五日付薬発五九八号厚生省薬務局長通知)
4
粗原薬とは、精製前の化合物を指す。
5
後発医薬品のさらなる使用促進のためのロードマップ(平成 25 年4月5日公表)にて、後発
品メーカーが行うべき取組の一つとして、原薬の状況に応じたダブルソース化が求められた。
6