よむ、つかう、まなぶ。
【参考資料5】後発品の安定供給に関連する情報の公表等に関するガイドライン(令和6年3月29日) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39824.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第12回 4/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
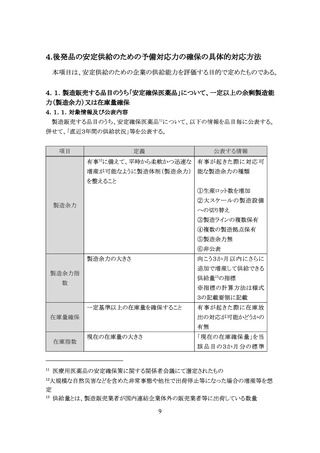
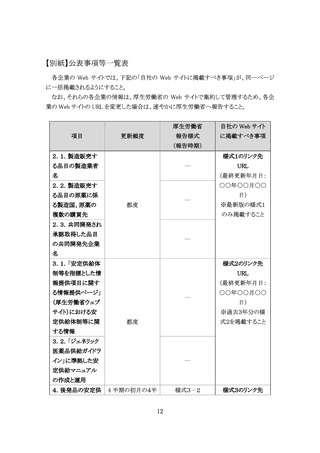
2.3.共同開発され承認取得した品目の共同開発先企業名
製造販売する品目のうち、共同開発6品目においては、開発主体となった企業を明確にした
上で、共同開発先の企業名(製造販売業者名)を公表する。
また、共同開発する医薬品の割合を可視化する観点から、自社が製造販売する後発品・そ
の他品目のうち、共同開発品目数の割合を公表することが望ましい。(任意の公表事項)
6
共同開発とは、医薬品の承認申請に際して、規格及び試験方法、安定性試験、生物学的
同等性試験の結果・データなどを、複数社で契約を結んだ上で、特定の企業が提出した資料
を共同で、複数の会社で利用して承認申請を行うことをいう。(平成 26 年 11 月 21 日薬食審
査発 1121 第 12 号 医薬品の承認申請に際し留意すべき事項についてより抜粋)
7
製造販売する品目のうち、共同開発6品目においては、開発主体となった企業を明確にした
上で、共同開発先の企業名(製造販売業者名)を公表する。
また、共同開発する医薬品の割合を可視化する観点から、自社が製造販売する後発品・そ
の他品目のうち、共同開発品目数の割合を公表することが望ましい。(任意の公表事項)
6
共同開発とは、医薬品の承認申請に際して、規格及び試験方法、安定性試験、生物学的
同等性試験の結果・データなどを、複数社で契約を結んだ上で、特定の企業が提出した資料
を共同で、複数の会社で利用して承認申請を行うことをいう。(平成 26 年 11 月 21 日薬食審
査発 1121 第 12 号 医薬品の承認申請に際し留意すべき事項についてより抜粋)
7