よむ、つかう、まなぶ。
【資料2】日本医療機器産業連合会提出資料.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40241.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第2回 5/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
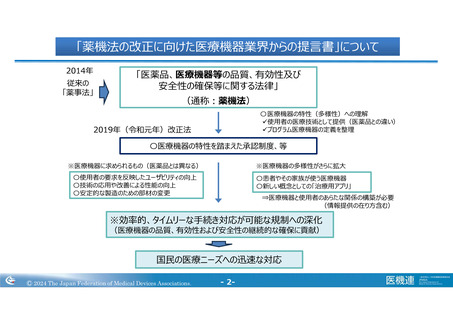
省令改正、運用等にて取り組むべき課題と提言
Ⅳ. 医療機器の開発推進のための省令改正等に関する提言
1. RWDを活用した医療機器開発の推進
2. 外国製造業者登録制度の運用見直し
3. 品目の特性に応じた製品届出制度の導入
4. 品目の技術情報の登録制度(原薬等登録原簿の拡充)
V. 医療機器の市販後安全対策を深化させるための省令改正等
1. 既知・未知などのリスクに応じた外国医療機器情報の報告の在り方
2. UDIの本体符号を用いた電子添文の本体表示の運用
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
-4-
テーマ②安全対策と品質確保
Ⅳ. 医療機器の開発推進のための省令改正等に関する提言
1. RWDを活用した医療機器開発の推進
2. 外国製造業者登録制度の運用見直し
3. 品目の特性に応じた製品届出制度の導入
4. 品目の技術情報の登録制度(原薬等登録原簿の拡充)
V. 医療機器の市販後安全対策を深化させるための省令改正等
1. 既知・未知などのリスクに応じた外国医療機器情報の報告の在り方
2. UDIの本体符号を用いた電子添文の本体表示の運用
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
-4-
テーマ②安全対策と品質確保