よむ、つかう、まなぶ。
【資料2】日本医療機器産業連合会提出資料.pdf (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40241.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第2回 5/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
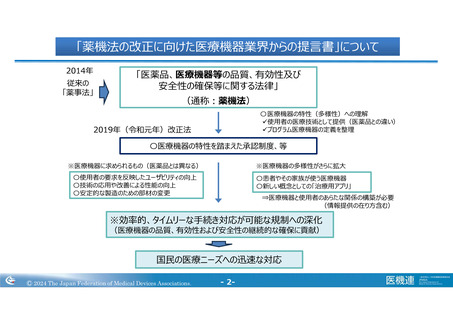
テーマ③:医療機器の規制の見直し
認証制度の安定とさらなる発展のための提案
背景と課題
医療機器の認証制度は、2005年法改正時に導入され、こ
れまでに17の認証機関が登録された。そのうち7機関の登録
が廃止したが、認証業務から撤退するときのルールが特に定
められていない。認証機関が事業撤退すると、認証取得して
いる企業はあらたな認証機関への移管が必要になり、想定
外の費用と作業が発生するなど、製造販売の継続が保証さ
れていない状況である。
現状、認証機関は、品目やQMSに係る情報データベースに
アクセスできないため、同等性評価や製造業者登録情報等
は申請企業からの情報に限られている。申請企業はその都
度情報提供が必要となり、申請企業、認証機関双方の負
担となっている。
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
-8-
提案
① 利用している企業が、迅速に認証機関を移行し、
製造販売を安定的に継続させるために、認証機関
が事業撤退する際のルール策定が重要と考える。
例えば、承継先の認証機関を選定可能、認証番
号の継続など、供給が滞らないことを目的とした施
策が重要である。
② 認証機関においても、機密情報の取扱いに関する
ルールを定め、調査業務に必要な情報へのアクセス
を可能とし、他社認証機関が認証した品目情報、
製造業者登録情報などを閲覧することで、業務効
率化のみならず、認証機関の底上げにもつながるこ
とが期待できるのではないか。
認証制度の安定とさらなる発展のための提案
背景と課題
医療機器の認証制度は、2005年法改正時に導入され、こ
れまでに17の認証機関が登録された。そのうち7機関の登録
が廃止したが、認証業務から撤退するときのルールが特に定
められていない。認証機関が事業撤退すると、認証取得して
いる企業はあらたな認証機関への移管が必要になり、想定
外の費用と作業が発生するなど、製造販売の継続が保証さ
れていない状況である。
現状、認証機関は、品目やQMSに係る情報データベースに
アクセスできないため、同等性評価や製造業者登録情報等
は申請企業からの情報に限られている。申請企業はその都
度情報提供が必要となり、申請企業、認証機関双方の負
担となっている。
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
-8-
提案
① 利用している企業が、迅速に認証機関を移行し、
製造販売を安定的に継続させるために、認証機関
が事業撤退する際のルール策定が重要と考える。
例えば、承継先の認証機関を選定可能、認証番
号の継続など、供給が滞らないことを目的とした施
策が重要である。
② 認証機関においても、機密情報の取扱いに関する
ルールを定め、調査業務に必要な情報へのアクセス
を可能とし、他社認証機関が認証した品目情報、
製造業者登録情報などを閲覧することで、業務効
率化のみならず、認証機関の底上げにもつながるこ
とが期待できるのではないか。