よむ、つかう、まなぶ。
【資料2】日本医療機器産業連合会提出資料.pdf (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40241.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第2回 5/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
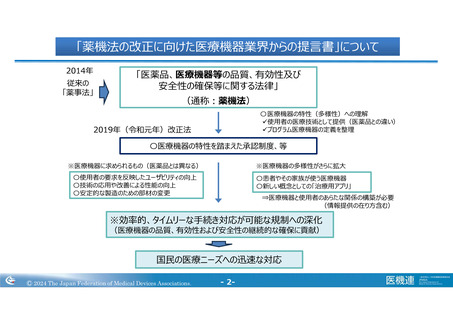
テーマ②:リスクに基づく市販後安全対策と品質確保の取組み
国際整合を鑑みたQMS適合性調査制度のあり方の検討
背景と課題
提案
医療機器製造にかかわるサプライチェーンのグローバル化と複雑化
が進んでいること、また国内医療機器の海外進出が期待されてい
る中、MDSAP制度*のさらなる利活用促進が求められ、また日
本のQMS調査報告書に関するリライアンスをさらに進めるために
も、なお一層のQMS調査制度の国際整合が重要ではないか。
海外主要国/地域(例えばMDSAP加盟国や欧州)では、(法
的)製造業者を中心とした品質マネジメントシステムを網羅する調
査が実施されている。QMSシステム単位による調査が、医療機
器におけるQMS調査制度のあるべき姿ではないか。
QMS調査が申請品目単位で実施される(同一製品群で同一
製造所パターンにおける調査実績がある場合を除く)ため、同一
製造所に対して複数の調査が発生している。さらに基準適合証
の数は膨大となり、複雑な管理が必要となるため、変更管理エラ
ーや更新漏れのリスクが内在している。
① 国際整合を前提にしたQMSシステム調査制度
を目指し、「QMS調査制度のあり方」について官
民で連携し、調査制度として抜本的な進展が図
れるよう、具体的な内容(調査の対象、調査頻
度、調査権者など)を検討することが重要ではな
いか。
② 当面の運用改善として、基準適合証の対象範
囲を見直しすることで(例えば、製品群の集約、
対象製造所の考え方の整理など)、調査の重複
を解消させることによる調査者と申請者の業務の
効率化の確保、また基準適合証の変更や更新
漏れのリスクを低減させることが必要ではないか。
* MDSAP (Medical Device Single Audit Program): 各国の規制当局にて構成されるフォーラム(IMDRF)にて議論
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
-7-
国際整合を鑑みたQMS適合性調査制度のあり方の検討
背景と課題
提案
医療機器製造にかかわるサプライチェーンのグローバル化と複雑化
が進んでいること、また国内医療機器の海外進出が期待されてい
る中、MDSAP制度*のさらなる利活用促進が求められ、また日
本のQMS調査報告書に関するリライアンスをさらに進めるために
も、なお一層のQMS調査制度の国際整合が重要ではないか。
海外主要国/地域(例えばMDSAP加盟国や欧州)では、(法
的)製造業者を中心とした品質マネジメントシステムを網羅する調
査が実施されている。QMSシステム単位による調査が、医療機
器におけるQMS調査制度のあるべき姿ではないか。
QMS調査が申請品目単位で実施される(同一製品群で同一
製造所パターンにおける調査実績がある場合を除く)ため、同一
製造所に対して複数の調査が発生している。さらに基準適合証
の数は膨大となり、複雑な管理が必要となるため、変更管理エラ
ーや更新漏れのリスクが内在している。
① 国際整合を前提にしたQMSシステム調査制度
を目指し、「QMS調査制度のあり方」について官
民で連携し、調査制度として抜本的な進展が図
れるよう、具体的な内容(調査の対象、調査頻
度、調査権者など)を検討することが重要ではな
いか。
② 当面の運用改善として、基準適合証の対象範
囲を見直しすることで(例えば、製品群の集約、
対象製造所の考え方の整理など)、調査の重複
を解消させることによる調査者と申請者の業務の
効率化の確保、また基準適合証の変更や更新
漏れのリスクを低減させることが必要ではないか。
* MDSAP (Medical Device Single Audit Program): 各国の規制当局にて構成されるフォーラム(IMDRF)にて議論
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
-7-