よむ、つかう、まなぶ。
【参考資料2】「経済財政運営と改革の基本方針2024」、「新しい資本主義のグランドデザイン及び実行計画2024年改訂版」及び「規制改革実行計画」の概要について(医薬局関係).pdf資料>合田委員提出資料.pdf (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「規制改革実施計画」
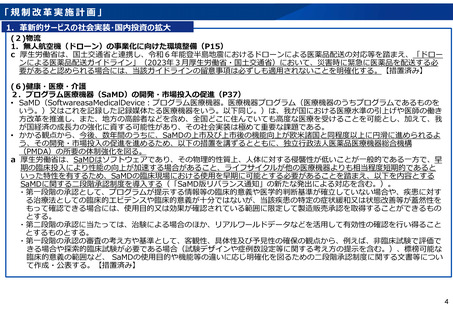
1.革新的サービスの社会実装・国内投資の拡大
18.先端技術を用いた医薬品開発ツールの要件の明確化(P61)
a 厚生労働省は、医薬品開発のスピードや質の向上を図るとともに、医薬品開発における技術活用の予見可能性を高める観点か
ら、動物実験の代替となり得るMPS(MicrophysiologicalSystems:生体模倣システム)などの先端技術について、当該技術の
要件の明確化に資するガイドラインの作成・公表などの具体的な方策について、産業界やアカデミアの関係者との協議や海外
における取扱い等の必要な調査を行う。当該協議・調査を踏まえ、要件の明確化に資するガイドラインの作成・公表などの具
体的な方策について検討を行い、結論を得る。【(前段)令和6年度措置、(後段)令和7年度結論】
19.低リスク遺伝子治療用製品の開発における治験開始前の環境影響評価(P61)
a 厚生労働省は、事業者の過度な負担にならないよう、国内外で承認済みの再生医療等製品で安全性が確認されている非増殖性
かつ低病原性のリスクの低いベクターの治験開始前の環境影響評価について、カルタヘナ議定書の内容や締結国の状況につい
て実態調査を行う。当該調査も踏まえ、事業者負担の軽減につながるような見直しの要否について検討し、結論を得る。
【(前段)令和6年度着手、令和7年度措置、(後段)令和7年度結論】
20.新医薬品の毒薬及び劇薬の指定基準の明確化(P61)
a 厚生労働省は、新医薬品の審査・評価の予見可能性を高める観点から、承認された毒薬・劇薬指定の根拠について、事業者の
求めに応じて回答する仕組みを設けることや、新医薬品に係る承認審査の標準的プロセスにおいて事業者に審査報告書を提示
するまでの間に、毒薬及び劇薬に該当する可能性の有無及びその根拠等の案を事業者に対して事前に提示することを含め検討
し、結論を得る。
21.再生医療製品及び医薬品の製造に用いる生物由来原料等の管理等の合理化(P62)
• 厚生労働省は、原料等が種類別に設けられている生物由来原料基準について、当該基準に適合しない場合でも個別製品ごとに
リスク評価を行っているところ、事業者の事務負担の更なる軽減を図るため、当該基準のうちウイルス等の感染リスクが低い
「ヒト/動物細胞株を用いた遺伝子組換えタンパク質」については、より緩和された管理基準の在り方を検討し、結論を得る。
厚生労働省は、生物由来原料基準の運用に当たり、その包括的なリスクアセスメントに関する事業者の予見可能性を更に高め
るため、「生物由来原料基準の運用について」(平成26年10月2日厚生労働省医薬食品局審査管理課長・大臣官房参事官(医
療機器・再生医療等製品審査管理担当)連名通知)について、再生医療等製品や医薬品の製造工程や特徴も踏まえた、より明
確な取扱いを示すよう検討を行い、結論を得る。【令和6年度結論】
10
1.革新的サービスの社会実装・国内投資の拡大
18.先端技術を用いた医薬品開発ツールの要件の明確化(P61)
a 厚生労働省は、医薬品開発のスピードや質の向上を図るとともに、医薬品開発における技術活用の予見可能性を高める観点か
ら、動物実験の代替となり得るMPS(MicrophysiologicalSystems:生体模倣システム)などの先端技術について、当該技術の
要件の明確化に資するガイドラインの作成・公表などの具体的な方策について、産業界やアカデミアの関係者との協議や海外
における取扱い等の必要な調査を行う。当該協議・調査を踏まえ、要件の明確化に資するガイドラインの作成・公表などの具
体的な方策について検討を行い、結論を得る。【(前段)令和6年度措置、(後段)令和7年度結論】
19.低リスク遺伝子治療用製品の開発における治験開始前の環境影響評価(P61)
a 厚生労働省は、事業者の過度な負担にならないよう、国内外で承認済みの再生医療等製品で安全性が確認されている非増殖性
かつ低病原性のリスクの低いベクターの治験開始前の環境影響評価について、カルタヘナ議定書の内容や締結国の状況につい
て実態調査を行う。当該調査も踏まえ、事業者負担の軽減につながるような見直しの要否について検討し、結論を得る。
【(前段)令和6年度着手、令和7年度措置、(後段)令和7年度結論】
20.新医薬品の毒薬及び劇薬の指定基準の明確化(P61)
a 厚生労働省は、新医薬品の審査・評価の予見可能性を高める観点から、承認された毒薬・劇薬指定の根拠について、事業者の
求めに応じて回答する仕組みを設けることや、新医薬品に係る承認審査の標準的プロセスにおいて事業者に審査報告書を提示
するまでの間に、毒薬及び劇薬に該当する可能性の有無及びその根拠等の案を事業者に対して事前に提示することを含め検討
し、結論を得る。
21.再生医療製品及び医薬品の製造に用いる生物由来原料等の管理等の合理化(P62)
• 厚生労働省は、原料等が種類別に設けられている生物由来原料基準について、当該基準に適合しない場合でも個別製品ごとに
リスク評価を行っているところ、事業者の事務負担の更なる軽減を図るため、当該基準のうちウイルス等の感染リスクが低い
「ヒト/動物細胞株を用いた遺伝子組換えタンパク質」については、より緩和された管理基準の在り方を検討し、結論を得る。
厚生労働省は、生物由来原料基準の運用に当たり、その包括的なリスクアセスメントに関する事業者の予見可能性を更に高め
るため、「生物由来原料基準の運用について」(平成26年10月2日厚生労働省医薬食品局審査管理課長・大臣官房参事官(医
療機器・再生医療等製品審査管理担当)連名通知)について、再生医療等製品や医薬品の製造工程や特徴も踏まえた、より明
確な取扱いを示すよう検討を行い、結論を得る。【令和6年度結論】
10