よむ、つかう、まなぶ。
【参考資料2】「経済財政運営と改革の基本方針2024」、「新しい資本主義のグランドデザイン及び実行計画2024年改訂版」及び「規制改革実行計画」の概要について(医薬局関係).pdf資料>合田委員提出資料.pdf (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「規制改革実施計画」
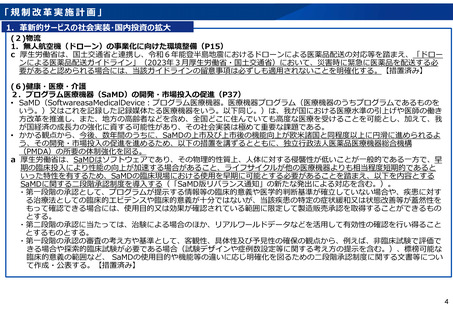
1.革新的サービスの社会実装・国内投資の拡大
5.販売機の活用による一般用医薬品の遠隔販売(P46)
• 「医薬品の販売制度に関する検討会」において議論された、デジタル技術を活用した一般用医薬品の遠隔販売(販売機の活用
を含む。)について、同検討会のとりまとめを踏まえ、離島やへき地など、医薬品へのアクセスが困難な地域における医薬品
の販売を可能とする制度について、令和6年度に検討を開始し結論を得る。【令和6年度検討開始・結論】
7.在宅医療における円滑な薬物治療の提供(P48)
• 厚生労働省は、在宅患者が適時に必要な薬剤(薬局では取り扱っていないことがあると指摘されている種類の輸液等を含
む。)を入手できないことがないよう、在宅患者への適時の薬物治療の対応が夜間・休日を含め24時間365日可能な薬局が存
在しない地域における必要な体制の整備などの必要な対応を検討するため、一次医療圏ごとの薬局における在宅対応に関する
体制・機能等の情報(名称、所在地、連絡先公表の有無(営業時間内、夜間・休日)、営業時間、夜間・休日の対応状況(輪
番体制への参加状況含む。)、地域支援体制加算の有無、地域連携薬局の認定の有無等)を公開する。【令和6年度上期措
置】
11.被験者保護及び研究力強化等のための倫理審査の適正化(P51)
• 内閣府、こども家庭庁、文部科学省、厚生労働省及び経済産業省は、①我が国において、医薬品、医療機器等の品質、有効性
及び安全性の確保等に関する法律が適用される治験、臨床研究法(平成29年法律第16号)が適用される臨床研究、人を対象と
する生命科学・医学系研究に関する倫理指針(令和3年文部科学省・厚生労働省・経済産業省告示第1号)等が適用される研
究等(以下「治験・研究」という。)を行う場合には、海外と異なり、その目的と種類によって適用される法規制が異なって
いること等を背景として、治験・研究の内容によって異なる対応(異なる委員会による審査への対応を含む。)が求められる
ことが大きな負荷となっていることや倫理審査委員会等の審査の質のばらつき等の一因になっているなどの指摘があること、
②我が国の治験パフォーマンスは海外に比べ低く、また、治験環境は海外に比べコスト面での違いが大きいとの指摘や、国際
共同治験において我が国が選ばれないことがドラッグ・ラグやドラッグ・ロスの一因となっているとの指摘があること、③欧
米では、一つの治験・研究を複数施設で共同して行う場合、当該治験・研究を行うことの適否その他の治験・研究に関する調
査審議について、一括した審査(以下「一括審査」という。)が我が国に比べ普及している一方、我が国では、各制度の下で
実施される治験・研究において一括審査を推進しているが、必ずしも十分に普及していないことにより、手続、様式、費用、
開催頻度等の異なる倫理審査が求められる結果、企業、研究者等にとって負担が生じているとの指摘があること、④我が国で
一括審査が普及しない要因として、治験・研究実施機関にとって他の機関等に設置された委員会に対する審査の質への不安が
あるとの指摘があることなどを踏まえ、被験者保護及び研究力強化等のための倫理審査の更なる適正化を実現するため、政府
横断的に検討し、以下の措置を講ずる。
a 内閣府、こども家庭庁、文部科学省、厚生労働省及び経済産業省は、我が国における一括審査の普及に関する目標として、国
際共同試験への我が国の参加の状況、欧米の一括審査に関する水準等も踏まえ、欧米と同程度の水準とする方向で、我が国に 7
おける一括審査の実施状況に関する数値目標を設定する。【令和6年度検討開始、令和7年までに結論・措置】
1.革新的サービスの社会実装・国内投資の拡大
5.販売機の活用による一般用医薬品の遠隔販売(P46)
• 「医薬品の販売制度に関する検討会」において議論された、デジタル技術を活用した一般用医薬品の遠隔販売(販売機の活用
を含む。)について、同検討会のとりまとめを踏まえ、離島やへき地など、医薬品へのアクセスが困難な地域における医薬品
の販売を可能とする制度について、令和6年度に検討を開始し結論を得る。【令和6年度検討開始・結論】
7.在宅医療における円滑な薬物治療の提供(P48)
• 厚生労働省は、在宅患者が適時に必要な薬剤(薬局では取り扱っていないことがあると指摘されている種類の輸液等を含
む。)を入手できないことがないよう、在宅患者への適時の薬物治療の対応が夜間・休日を含め24時間365日可能な薬局が存
在しない地域における必要な体制の整備などの必要な対応を検討するため、一次医療圏ごとの薬局における在宅対応に関する
体制・機能等の情報(名称、所在地、連絡先公表の有無(営業時間内、夜間・休日)、営業時間、夜間・休日の対応状況(輪
番体制への参加状況含む。)、地域支援体制加算の有無、地域連携薬局の認定の有無等)を公開する。【令和6年度上期措
置】
11.被験者保護及び研究力強化等のための倫理審査の適正化(P51)
• 内閣府、こども家庭庁、文部科学省、厚生労働省及び経済産業省は、①我が国において、医薬品、医療機器等の品質、有効性
及び安全性の確保等に関する法律が適用される治験、臨床研究法(平成29年法律第16号)が適用される臨床研究、人を対象と
する生命科学・医学系研究に関する倫理指針(令和3年文部科学省・厚生労働省・経済産業省告示第1号)等が適用される研
究等(以下「治験・研究」という。)を行う場合には、海外と異なり、その目的と種類によって適用される法規制が異なって
いること等を背景として、治験・研究の内容によって異なる対応(異なる委員会による審査への対応を含む。)が求められる
ことが大きな負荷となっていることや倫理審査委員会等の審査の質のばらつき等の一因になっているなどの指摘があること、
②我が国の治験パフォーマンスは海外に比べ低く、また、治験環境は海外に比べコスト面での違いが大きいとの指摘や、国際
共同治験において我が国が選ばれないことがドラッグ・ラグやドラッグ・ロスの一因となっているとの指摘があること、③欧
米では、一つの治験・研究を複数施設で共同して行う場合、当該治験・研究を行うことの適否その他の治験・研究に関する調
査審議について、一括した審査(以下「一括審査」という。)が我が国に比べ普及している一方、我が国では、各制度の下で
実施される治験・研究において一括審査を推進しているが、必ずしも十分に普及していないことにより、手続、様式、費用、
開催頻度等の異なる倫理審査が求められる結果、企業、研究者等にとって負担が生じているとの指摘があること、④我が国で
一括審査が普及しない要因として、治験・研究実施機関にとって他の機関等に設置された委員会に対する審査の質への不安が
あるとの指摘があることなどを踏まえ、被験者保護及び研究力強化等のための倫理審査の更なる適正化を実現するため、政府
横断的に検討し、以下の措置を講ずる。
a 内閣府、こども家庭庁、文部科学省、厚生労働省及び経済産業省は、我が国における一括審査の普及に関する目標として、国
際共同試験への我が国の参加の状況、欧米の一括審査に関する水準等も踏まえ、欧米と同程度の水準とする方向で、我が国に 7
おける一括審査の実施状況に関する数値目標を設定する。【令和6年度検討開始、令和7年までに結論・措置】