よむ、つかう、まなぶ。
【参考資料2】「経済財政運営と改革の基本方針2024」、「新しい資本主義のグランドデザイン及び実行計画2024年改訂版」及び「規制改革実行計画」の概要について(医薬局関係).pdf資料>合田委員提出資料.pdf (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
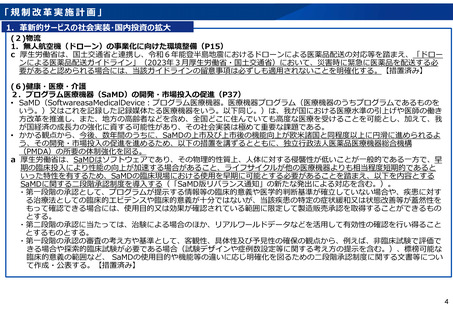
「規制改革実施計画」
1.革新的サービスの社会実装・国内投資の拡大
c 厚生労働省は、a 及び b の仕組みの実施状況及び海外の一部の国においては非臨床試験のみで時限的に薬事上の承認を付与
し保険適用する仕組みが実装されており、臨床現場での早期の使用が可能となっているとの指摘があることを踏まえ、各国
における医療制度等の違いに留意しつつ、我が国における薬事上の承認と保険適用の在り方については、臨床現場での早期
の使用を可能にする観点から、我が国の新たな制度である二段階承認制度の活用を推進するとともに、医療技術の新陳代謝
を加速する観点から、新たな有効性が示された場合には診療報酬改定ごとの頻度に限らずに保険適用の見直しを可能とする
ことを含めた仕組みについて検討する。なお、検討に当たっては、我が国が世界を牽引するようなSaMDの開発・供給体
制整備を促進する観点から、欧米諸国と上市までのスピードを比較する際には、審査ラグ(総審査期間の差)のみならず、
開発ラグ(申請時期の差)を含めて比較することに留意する。【引き続き検討を進め、令和7年度結論】
g 厚生労働省は、医療機器情報に対する患者のアクセスを円滑化するため、医家向け医療機器に関する広告規制について、患
者や産業界のニーズを踏まえ選定した品目(発作時心臓活動記録装置、発作時心臓活動記録装置用プログラム、高血圧治療
補助プログラム、禁煙治療補助システム、間欠泌尿器用カテーテル、弾性ストッキング、自己検査用グルコース測定器等)
ごとにガイドラインを作成した上で、当該品目について、医家向け医療機器のインターネット上の出品(広告)を可能とす
る。【措置済み】
h SaMDは、他の医療機器の開発と異なり、スタートアップなどがごく少人数で開発・生産を行う内外の実情がある一方で、我
が国では、医療機器の製造に当たり選任が必要となる国内品質業務運営責任者(以下「品責」という。)の要件を満たす人
材が限られ、特に、ソフトウェア開発に関する知見を有する者は更に限られるとの指摘がある。このため、厚生労働省は、
スタートアップ等によるSaMDの開発及び生産を円滑化する観点から、品責の資格要件の一つである3年以上の品質管理業務
等の職務経験について、講習の受講等により代替することを可能とする。なお、当該検討に当たっては、 SaMDについては、
薬事法等の一部を改正する法律及び薬事法等の一部を改正する法律の施行に伴う関係政令の整備等及び経過措置に関する政
令の施行に伴う関係省令の整備等に関する省令(平成26年厚生労働省令第87号)における経過措置として、平成26年から平
成29年までの間、厚生労働大臣の登録を受けた者が行う講習を修了した者は、3年以上の品質管理業務等に従事した者とみ
なすこととされていたことを踏まえることとする。【措置済み】
5
1.革新的サービスの社会実装・国内投資の拡大
c 厚生労働省は、a 及び b の仕組みの実施状況及び海外の一部の国においては非臨床試験のみで時限的に薬事上の承認を付与
し保険適用する仕組みが実装されており、臨床現場での早期の使用が可能となっているとの指摘があることを踏まえ、各国
における医療制度等の違いに留意しつつ、我が国における薬事上の承認と保険適用の在り方については、臨床現場での早期
の使用を可能にする観点から、我が国の新たな制度である二段階承認制度の活用を推進するとともに、医療技術の新陳代謝
を加速する観点から、新たな有効性が示された場合には診療報酬改定ごとの頻度に限らずに保険適用の見直しを可能とする
ことを含めた仕組みについて検討する。なお、検討に当たっては、我が国が世界を牽引するようなSaMDの開発・供給体
制整備を促進する観点から、欧米諸国と上市までのスピードを比較する際には、審査ラグ(総審査期間の差)のみならず、
開発ラグ(申請時期の差)を含めて比較することに留意する。【引き続き検討を進め、令和7年度結論】
g 厚生労働省は、医療機器情報に対する患者のアクセスを円滑化するため、医家向け医療機器に関する広告規制について、患
者や産業界のニーズを踏まえ選定した品目(発作時心臓活動記録装置、発作時心臓活動記録装置用プログラム、高血圧治療
補助プログラム、禁煙治療補助システム、間欠泌尿器用カテーテル、弾性ストッキング、自己検査用グルコース測定器等)
ごとにガイドラインを作成した上で、当該品目について、医家向け医療機器のインターネット上の出品(広告)を可能とす
る。【措置済み】
h SaMDは、他の医療機器の開発と異なり、スタートアップなどがごく少人数で開発・生産を行う内外の実情がある一方で、我
が国では、医療機器の製造に当たり選任が必要となる国内品質業務運営責任者(以下「品責」という。)の要件を満たす人
材が限られ、特に、ソフトウェア開発に関する知見を有する者は更に限られるとの指摘がある。このため、厚生労働省は、
スタートアップ等によるSaMDの開発及び生産を円滑化する観点から、品責の資格要件の一つである3年以上の品質管理業務
等の職務経験について、講習の受講等により代替することを可能とする。なお、当該検討に当たっては、 SaMDについては、
薬事法等の一部を改正する法律及び薬事法等の一部を改正する法律の施行に伴う関係政令の整備等及び経過措置に関する政
令の施行に伴う関係省令の整備等に関する省令(平成26年厚生労働省令第87号)における経過措置として、平成26年から平
成29年までの間、厚生労働大臣の登録を受けた者が行う講習を修了した者は、3年以上の品質管理業務等に従事した者とみ
なすこととされていたことを踏まえることとする。【措置済み】
5