よむ、つかう、まなぶ。
【参考資料2】「経済財政運営と改革の基本方針2024」、「新しい資本主義のグランドデザイン及び実行計画2024年改訂版」及び「規制改革実行計画」の概要について(医薬局関係).pdf資料>合田委員提出資料.pdf (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41209.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第4回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
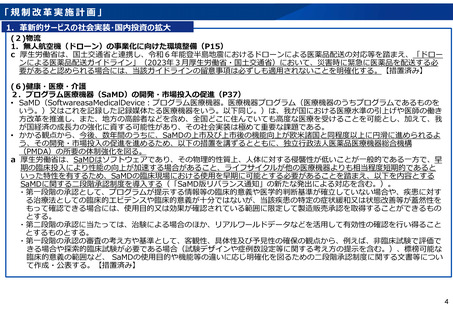
「規制改革実施計画」
1.革新的サービスの社会実装・国内投資の拡大
b 内閣府、こども家庭庁、文部科学省、厚生労働省及び経済産業省は、aの目標を達成するため、競争的研究費の提供を受ける治
験・研究について、多機関共同研究を実施する場合には一括審査を必須要件に位置付ける。ただし、少数の研究機関がそれぞ
れ異なる内容を分担する基礎的研究については、必ずしもこの限りではない。あわせて、内閣府、こども家庭庁、文部科学省、
厚生労働省及び経済産業省は、その他の一括審査の普及促進に資する方策のほか、①審査が必要な安全性情報の範囲の特定、
個人情報の保護に関する法律(平成15年法律第57号)等を遵守するための審査項目の明確化、治験・研究実施機関追加の際の
審査の要否その他の審査事項等の更なる整理、②審査の議事概要の公表の促進を通じた審査の可視化、③審査委員の教育・研
修の実施など、審査の質の担保・向上に資する方策について、各制度の規制調和・国際整合の観点から、各制度で共通する事
項を整合させることに留意した上で検討し、結論を得た上で、実施する。【(前段)令和6年度検討開始、令和7年度までに
結論・措置、(後段)令和6年度検討開始、令和8年度までに結論・措置】
15.スイッチOTC化の加速(P55)
a 個人の健康管理に係る自発的な取組を促す観点から、セルフメディケーション(自分自身の健康に責任を持ち、軽度な身体の
不調は自分で手当てすること(世界保健機関))の推進が累次の閣議決定(「経済財政運営と改革の基本方針2023」(令和5
年6月16日閣議決定)等)によっても求められている。このため、安全性の確保を前提としつつ、患者がより効果の高い医薬
品に円滑にアクセスできることが必要であり、一般用医薬品(スイッチOTC)の選択肢拡大が求められている。
他方、我が国においては、いわゆる「スイッチ・ラグ」(海外において医師の診察が必要な医薬品から医師の診察が不要なOT
C医薬品に転用された時点から同医薬品が日本でOTC医薬品に転用される時点までの時間差)が長期間にわたる医薬品が多
数(令和5年12月現在、胃酸分泌抑制薬、片頭痛薬など70成分以上)存在し、特に、患者ニーズが高いと認められる医薬品に
ついても最長20年以上スイッチOTC化の遅れが生じている。我が国において過去3年間(令和3年4月から令和5年12月現
在まで)でスイッチOTC化されたのは7成分にすぎない。一方で、厚生労働省は、令和2年度措置が閣議決定されていたス
イッチOTC化を促進するための目標を設定していない。この結果、規制改革推進会議がスイッチOTC化の進捗を評価する
ことも行うことができない状況にある。
なお、我が国では国民皆保険が採用されているが、それは国民に対し医療にアクセスできる自由を確保している一方で、国民
に受診が強制されるものではなく、また、医療へのアクセス自体も年々困難になっているため、スイッチOTCの必要が何ら
減じるものではない。
厚生労働省は、こうした状況を踏まえ、令和5年末時点で海外2か国以上でスイッチOTC化されている医薬品については、
原則として3年以内(令和8年末まで)に日本でもOTC化する(スイッチ・ラグを解消する)ことを目標(令和7年以降に
申請されたものについては、①、②を目標)として設定し、関係審議会等の審査・審議・意思決定プロセスの見直し等必要な
措置を講ずることにより、国内でスイッチOTC化の要望があり申請されたものについては、原則として、①「医療用から要
指導・一般用への転用に関する評価検討会議」(以下「評価検討会議」という。)への要望書の提出時点から総期間1年以内
(令和5年以前に要望があったものは令和6年末まで)に検討結果を取りまとめ、また、②承認申請から承認の可否を判断す
るまでの総期間1年以内(令和5年以前に申請されたものは令和6年末まで)とする。【措置済み】
8
1.革新的サービスの社会実装・国内投資の拡大
b 内閣府、こども家庭庁、文部科学省、厚生労働省及び経済産業省は、aの目標を達成するため、競争的研究費の提供を受ける治
験・研究について、多機関共同研究を実施する場合には一括審査を必須要件に位置付ける。ただし、少数の研究機関がそれぞ
れ異なる内容を分担する基礎的研究については、必ずしもこの限りではない。あわせて、内閣府、こども家庭庁、文部科学省、
厚生労働省及び経済産業省は、その他の一括審査の普及促進に資する方策のほか、①審査が必要な安全性情報の範囲の特定、
個人情報の保護に関する法律(平成15年法律第57号)等を遵守するための審査項目の明確化、治験・研究実施機関追加の際の
審査の要否その他の審査事項等の更なる整理、②審査の議事概要の公表の促進を通じた審査の可視化、③審査委員の教育・研
修の実施など、審査の質の担保・向上に資する方策について、各制度の規制調和・国際整合の観点から、各制度で共通する事
項を整合させることに留意した上で検討し、結論を得た上で、実施する。【(前段)令和6年度検討開始、令和7年度までに
結論・措置、(後段)令和6年度検討開始、令和8年度までに結論・措置】
15.スイッチOTC化の加速(P55)
a 個人の健康管理に係る自発的な取組を促す観点から、セルフメディケーション(自分自身の健康に責任を持ち、軽度な身体の
不調は自分で手当てすること(世界保健機関))の推進が累次の閣議決定(「経済財政運営と改革の基本方針2023」(令和5
年6月16日閣議決定)等)によっても求められている。このため、安全性の確保を前提としつつ、患者がより効果の高い医薬
品に円滑にアクセスできることが必要であり、一般用医薬品(スイッチOTC)の選択肢拡大が求められている。
他方、我が国においては、いわゆる「スイッチ・ラグ」(海外において医師の診察が必要な医薬品から医師の診察が不要なOT
C医薬品に転用された時点から同医薬品が日本でOTC医薬品に転用される時点までの時間差)が長期間にわたる医薬品が多
数(令和5年12月現在、胃酸分泌抑制薬、片頭痛薬など70成分以上)存在し、特に、患者ニーズが高いと認められる医薬品に
ついても最長20年以上スイッチOTC化の遅れが生じている。我が国において過去3年間(令和3年4月から令和5年12月現
在まで)でスイッチOTC化されたのは7成分にすぎない。一方で、厚生労働省は、令和2年度措置が閣議決定されていたス
イッチOTC化を促進するための目標を設定していない。この結果、規制改革推進会議がスイッチOTC化の進捗を評価する
ことも行うことができない状況にある。
なお、我が国では国民皆保険が採用されているが、それは国民に対し医療にアクセスできる自由を確保している一方で、国民
に受診が強制されるものではなく、また、医療へのアクセス自体も年々困難になっているため、スイッチOTCの必要が何ら
減じるものではない。
厚生労働省は、こうした状況を踏まえ、令和5年末時点で海外2か国以上でスイッチOTC化されている医薬品については、
原則として3年以内(令和8年末まで)に日本でもOTC化する(スイッチ・ラグを解消する)ことを目標(令和7年以降に
申請されたものについては、①、②を目標)として設定し、関係審議会等の審査・審議・意思決定プロセスの見直し等必要な
措置を講ずることにより、国内でスイッチOTC化の要望があり申請されたものについては、原則として、①「医療用から要
指導・一般用への転用に関する評価検討会議」(以下「評価検討会議」という。)への要望書の提出時点から総期間1年以内
(令和5年以前に要望があったものは令和6年末まで)に検討結果を取りまとめ、また、②承認申請から承認の可否を判断す
るまでの総期間1年以内(令和5年以前に申請されたものは令和6年末まで)とする。【措置済み】
8