よむ、つかう、まなぶ。
参考資料1:令和5年度厚生労働科学特別研究事業(沖田班)総括研究 報告書一部抜粋 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
番
号
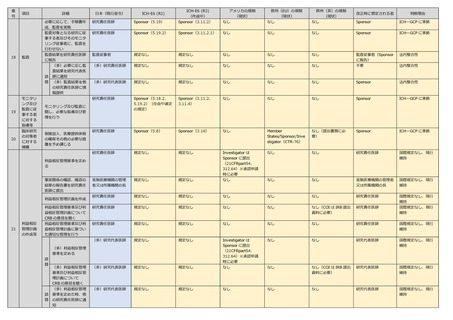
22
CRB 意見を速やかに管
理者に報告
(多)CRB 意見を
速やかに管理者に報
告するとともに、他
の研究責任医師に情
報提供
研究責任医師
規定なし
ICH-E6 (R3)
(作成中)
規定なし
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
研究代表医師
(Sponsor へも情報
提供)
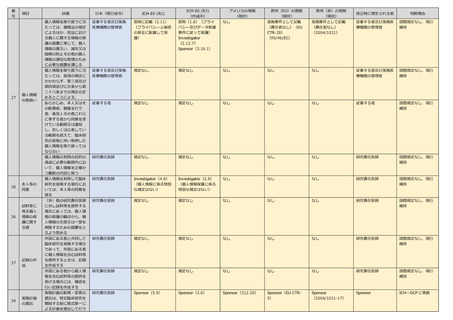
読
替
(多)研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
国際規定なし、法内
整合性
(多)研究責任医師
Investigator(4.4)
Sponsor は審査結果を
確認(5.11)
Investigator(2.4)
/Sponsor(3.8)(適
用される規制要件によ
る)
Investigator
(312.66)
Sponsor(EU CTR)
Chief Investigator
(Regulation2004/10
31-14)
研究代表医師
国際整合性等を踏ま
えた実施責務者
苦情及び問合せ窓口設
置、対応の手順策定その
他の必要な体制を整備
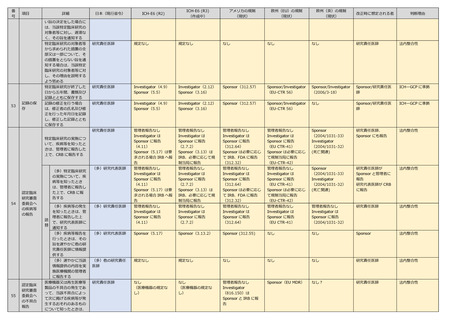
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師/研究代
表医師
国際規定なし、現行
維持
研究実施・変更時は
jRCT で公表
研究責任医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
Sponsor(EU CTR)
なし
Sponsor
国際整合性
データ収集後1年以内に
主要評価項目報告書・総
括報告書及びその概要を
作成
主要評価項目報告書作成
時の実施計画の変更
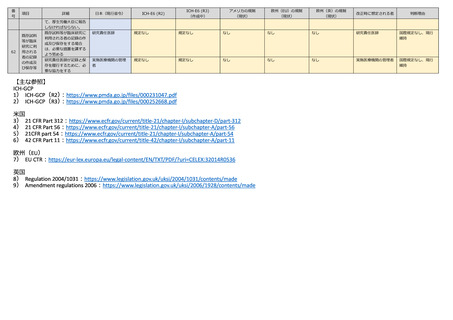
研究責任医師
Sponsor(5.22)
(期限の規定はない)
Sponsor(3.17)
(期限の規定はない)
なし
なし
なし
Sponsor
ICHーGCP に準拠
研究責任医師
規定なし
規定なし
なし
なし
なし
Sponsor
法内整合性
主要評価項目報告書・総
括報告書及びその概要作
成時、遅滞なく管理者に
提出するとともに、報告
書概要を jRCT で公表
研究責任医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
(管理者報告はなし)
Sponsor(EU CTR37)
(管理者報告はなし)
なし
Sponsor、研究責任医
師が管理者に提出
法内整合性
管理者に報告書を提出し
ようとする時、CRB 意
見を聴くとともに CRB
審査から1月以内に
jRCT で公表
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
総括報告書の概要提出時
は、計画書と SAP を添
えて速やかに厚生労働大
臣に提出
実施計画新規・変更時、
軽微変更時、総括報告書
の概要の大臣提出時は
jRCT で公表を行ったも
のとみなす
研究責任医師
Sponsor(5.22)
Sponsor(3.17)
なし
なし
なし
Sponsor
ICHーGCP に準拠
研究責任医師
規定なし
規定なし
なし
Sponsor(EU CTR)
なし
Sponsor
法内整合性
(多)研究実施・変
更時は jRCT で公表
(多)研究代表医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
Sponsor(EU CTR)
なし
Sponsor
国際整合性
(多)主要評価項目
報告書作成時の実施
計画の変更
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
Sponsor
法内整合性
(多)主要評価項目
報告書・総括報告書
及びその概要作成
時、遅滞なく管理者
(多)研究代表医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
(管理者報告はなし)
Sponsor(EU CTR37)
(管理者報告はなし)
なし
Sponsor、研究責任医
師が管理者に提出
法内整合性
項目
認定臨床
研究審査
委員会の
意見への
対応
詳細
(多)速やかに情報
提供内容を管理者に
報告
(多)意見を尊重し
て必要な措置をとる
23
24
苦情及び
問合せへ
の対応
情報の公
表等
読
替
日本(現行省令)
ICH-E6 (R2)
アメリカの規制
(現状)
なし
欧州(EU)の規制
(現状)
なし
欧州(英)の規制
(現状)
なし
改正時に想定される者
研究責任医師
判断理由
国際規定なし、法内
整合性
国際規定なし、法内
整合性
号
22
CRB 意見を速やかに管
理者に報告
(多)CRB 意見を
速やかに管理者に報
告するとともに、他
の研究責任医師に情
報提供
研究責任医師
規定なし
ICH-E6 (R3)
(作成中)
規定なし
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
研究代表医師
(Sponsor へも情報
提供)
読
替
(多)研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
国際規定なし、法内
整合性
(多)研究責任医師
Investigator(4.4)
Sponsor は審査結果を
確認(5.11)
Investigator(2.4)
/Sponsor(3.8)(適
用される規制要件によ
る)
Investigator
(312.66)
Sponsor(EU CTR)
Chief Investigator
(Regulation2004/10
31-14)
研究代表医師
国際整合性等を踏ま
えた実施責務者
苦情及び問合せ窓口設
置、対応の手順策定その
他の必要な体制を整備
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師/研究代
表医師
国際規定なし、現行
維持
研究実施・変更時は
jRCT で公表
研究責任医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
Sponsor(EU CTR)
なし
Sponsor
国際整合性
データ収集後1年以内に
主要評価項目報告書・総
括報告書及びその概要を
作成
主要評価項目報告書作成
時の実施計画の変更
研究責任医師
Sponsor(5.22)
(期限の規定はない)
Sponsor(3.17)
(期限の規定はない)
なし
なし
なし
Sponsor
ICHーGCP に準拠
研究責任医師
規定なし
規定なし
なし
なし
なし
Sponsor
法内整合性
主要評価項目報告書・総
括報告書及びその概要作
成時、遅滞なく管理者に
提出するとともに、報告
書概要を jRCT で公表
研究責任医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
(管理者報告はなし)
Sponsor(EU CTR37)
(管理者報告はなし)
なし
Sponsor、研究責任医
師が管理者に提出
法内整合性
管理者に報告書を提出し
ようとする時、CRB 意
見を聴くとともに CRB
審査から1月以内に
jRCT で公表
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
総括報告書の概要提出時
は、計画書と SAP を添
えて速やかに厚生労働大
臣に提出
実施計画新規・変更時、
軽微変更時、総括報告書
の概要の大臣提出時は
jRCT で公表を行ったも
のとみなす
研究責任医師
Sponsor(5.22)
Sponsor(3.17)
なし
なし
なし
Sponsor
ICHーGCP に準拠
研究責任医師
規定なし
規定なし
なし
Sponsor(EU CTR)
なし
Sponsor
法内整合性
(多)研究実施・変
更時は jRCT で公表
(多)研究代表医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
Sponsor(EU CTR)
なし
Sponsor
国際整合性
(多)主要評価項目
報告書作成時の実施
計画の変更
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
Sponsor
法内整合性
(多)主要評価項目
報告書・総括報告書
及びその概要作成
時、遅滞なく管理者
(多)研究代表医師
規定なし
規定なし
Sponsor(42 CFR
Part 11)
(管理者報告はなし)
Sponsor(EU CTR37)
(管理者報告はなし)
なし
Sponsor、研究責任医
師が管理者に提出
法内整合性
項目
認定臨床
研究審査
委員会の
意見への
対応
詳細
(多)速やかに情報
提供内容を管理者に
報告
(多)意見を尊重し
て必要な措置をとる
23
24
苦情及び
問合せへ
の対応
情報の公
表等
読
替
日本(現行省令)
ICH-E6 (R2)
アメリカの規制
(現状)
なし
欧州(EU)の規制
(現状)
なし
欧州(英)の規制
(現状)
なし
改正時に想定される者
研究責任医師
判断理由
国際規定なし、法内
整合性
国際規定なし、法内
整合性