よむ、つかう、まなぶ。
参考資料1:令和5年度厚生労働科学特別研究事業(沖田班)総括研究 報告書一部抜粋 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
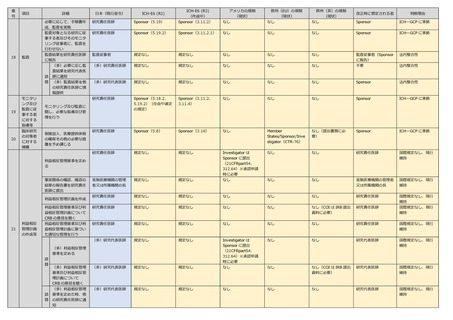
番
号
項目
62
既存試料
等が臨床
研究に利
用される
者の記録
の作成及
び保存等
詳細
て、厚生労働大臣に報告
しなければならない。
既存試料等が臨床研究に
利用される者の記録の作
成及び保存をする場合
は、必要な措置を講ずる
よう努める
研究責任医師が記録と保
存を履行するために、必
要な協力をする
日本(現行省令)
ICH-E6 (R2)
ICH-E6 (R3)
(作成中)
アメリカの規制
(現状)
欧州(EU)の規制
(現状)
欧州(英)の規制
(現状)
改正時に想定される者
判断理由
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
国際規定なし、現行
維持
実施医療機関の管理
者
規定なし
規定なし
なし
なし
なし
実施医療機関の管理者
国際規定なし、現行
維持
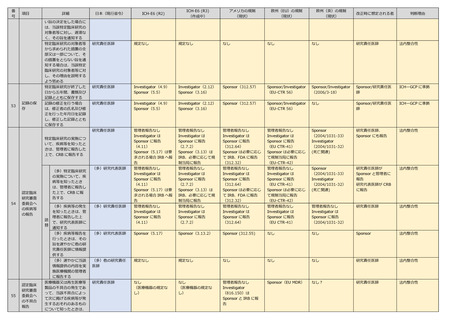
【主な参照】
ICH-GCP
1) ICH-GCP(R2)
:https://www.pmda.go.jp/files/000231047.pdf
2) ICH-GCP(R3)
:https://www.pmda.go.jp/files/000252668.pdf
米国
3) 21 CFR Part 312:https://www.ecfr.gov/current/title-21/chapter-I/subchapter-D/part-312
4) 21 CFR Part 56:https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-56
5) 21CFR part 54:https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-54
6) 42 CFR Part 11:https://www.ecfr.gov/current/title-42/chapter-I/subchapter-A/part-11
欧州(EU)
7) EU CTR:https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32014R0536
英国
8) Regulation 2004/1031:https://www.legislation.gov.uk/uksi/2004/1031/contents/made
9) Amendment regulations 2006:https://www.legislation.gov.uk/uksi/2006/1928/contents/made
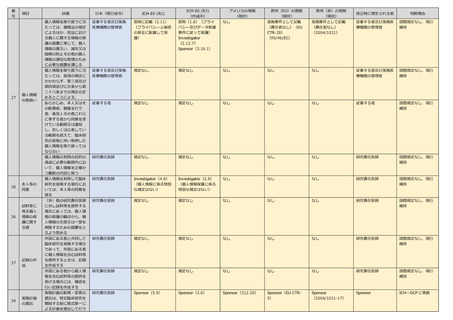
号
項目
62
既存試料
等が臨床
研究に利
用される
者の記録
の作成及
び保存等
詳細
て、厚生労働大臣に報告
しなければならない。
既存試料等が臨床研究に
利用される者の記録の作
成及び保存をする場合
は、必要な措置を講ずる
よう努める
研究責任医師が記録と保
存を履行するために、必
要な協力をする
日本(現行省令)
ICH-E6 (R2)
ICH-E6 (R3)
(作成中)
アメリカの規制
(現状)
欧州(EU)の規制
(現状)
欧州(英)の規制
(現状)
改正時に想定される者
判断理由
研究責任医師
規定なし
規定なし
なし
なし
なし
研究責任医師
国際規定なし、現行
維持
実施医療機関の管理
者
規定なし
規定なし
なし
なし
なし
実施医療機関の管理者
国際規定なし、現行
維持
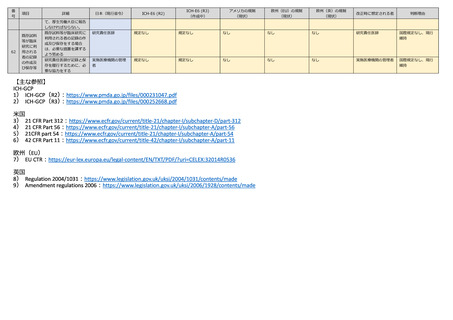
【主な参照】
ICH-GCP
1) ICH-GCP(R2)
:https://www.pmda.go.jp/files/000231047.pdf
2) ICH-GCP(R3)
:https://www.pmda.go.jp/files/000252668.pdf
米国
3) 21 CFR Part 312:https://www.ecfr.gov/current/title-21/chapter-I/subchapter-D/part-312
4) 21 CFR Part 56:https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-56
5) 21CFR part 54:https://www.ecfr.gov/current/title-21/chapter-I/subchapter-A/part-54
6) 42 CFR Part 11:https://www.ecfr.gov/current/title-42/chapter-I/subchapter-A/part-11
欧州(EU)
7) EU CTR:https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32014R0536
英国
8) Regulation 2004/1031:https://www.legislation.gov.uk/uksi/2004/1031/contents/made
9) Amendment regulations 2006:https://www.legislation.gov.uk/uksi/2006/1928/contents/made