よむ、つかう、まなぶ。
参考資料1:令和5年度厚生労働科学特別研究事業(沖田班)総括研究 報告書一部抜粋 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
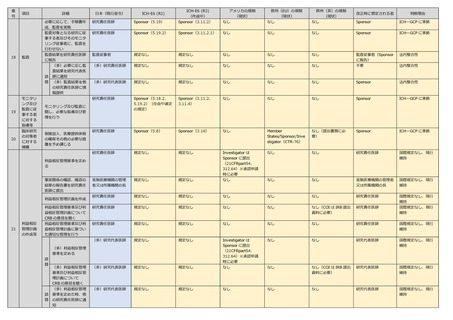
番
号
項目
詳細
日本(現行省令)
ICH-E6 (R2)
に提出するととも
に、報告書概要を
jRCT で公表
25
26
臨床研究
を行う際
の環境へ
の配慮
アメリカの規制
(現状)
欧州(EU)の規制
(現状)
欧州(英)の規制
(現状)
改正時に想定される者
判断理由
(多)管理者に報告
書を提出しようとす
る時、CRB 意見を
聴くとともに CRB
審査から1月以内に
jRCT で公表
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
研究代表医師
法内整合性
(多)総括報告書の
概要提出時は、計画
書と SAP を添えて
速やかに厚生労働大
臣に提出
(多)実施計画新
規・変更時、軽微変
更時、総括報告書の
概要の大臣提出時は
jRCT で公表を行っ
たものとみなす
(多)研究代表医師
Sponsor(5.22)
Sponsor(3.17)
なし
なし
なし
Sponsor
ICHーGCP に準拠
(多)研究代表医師
規定なし
規定なし
なし
Sponsor(EU CTR)
なし
Sponsor
法内整合性
(多)非特定で jRCT に
主要評価項目報告書・総
括報告書の概要を公表し
た時は速やかに管理者に
報告するとともに、他の
研究責任医師に情報提供
(多)研究代表医師
規定なし
管理者報告なし、
Sponsor は研究責任医
師に要約を提供
(3.17)
なし
なし
なし
Sponsor、研究責任医
師が管理者に報告
法内整合性
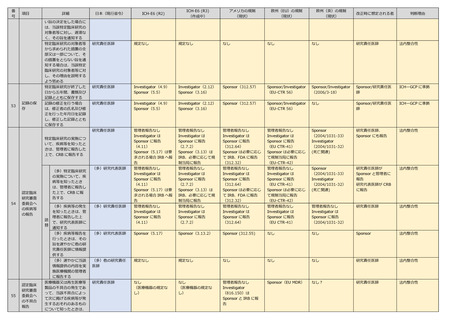
(多)総括報告書の
概要提出時に計画書
と SAP を添えて速
やかに厚生労働大臣
に提出した時は速や
かに管理者に報告す
るとともに他の研究
責任医師に情報提供
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
Sponsor、研究責任医
師が管理者に報告
法内整合性
(多)速やかに情報
提供内容を管理者に
報告
(多)他の研究責任
医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
研究に用いる医薬品等の
品質の確保のために必要
な措置を講じた上で製造
された医薬品等を用いて
臨床研究を実施
研究責任医師
施設 investigator
(4.6)
製造等 Sponsor
(5.13)
施設 investigator
(2.10)
製造等 Sponsor
(3.15)
Sponsor(312.22)
なし
Sponsor
Regulation2004/103
1)
Sponsor/研究責任医
師
ICHーGCP に準拠
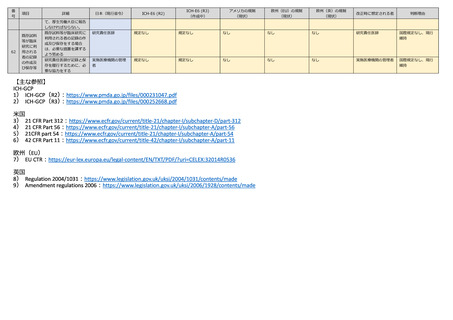
未承認医薬品等を用いる
臨床研究を実施する場合
その他臨床研究の内容に
応じて必要と判断される
場合は、記録を作成又は
入手
研究責任医師
施設 investigator
(4.6)
製造等 Sponsor
(5.14)
施設 investigator
(2.10)
製造等 Sponsor
(3.15)
Sponsor(312.56)
Investigator
(312.61, 312.62)
Sponsor/Investigator
(EU-CTR 56)
Sponsor
Regulation2004/103
1)
Sponsor/研究責任医
師
ICHーGCP に準拠
環境に影響を及ぼすおそ
れのある臨床研究を実施
する場合には、環境へ悪
影響を及ぼさないよう必
要な配慮をしなければな
らない。
研究責任医師
規定なし
規定なし
なし
なし
なし
Sponsor/研究責任医
師
国際規定なし、現行
維持
読
替
臨床研究
に用いる
医薬品等
の品質の
確保等
ICH-E6 (R3)
(作成中)
号
項目
詳細
日本(現行省令)
ICH-E6 (R2)
に提出するととも
に、報告書概要を
jRCT で公表
25
26
臨床研究
を行う際
の環境へ
の配慮
アメリカの規制
(現状)
欧州(EU)の規制
(現状)
欧州(英)の規制
(現状)
改正時に想定される者
判断理由
(多)管理者に報告
書を提出しようとす
る時、CRB 意見を
聴くとともに CRB
審査から1月以内に
jRCT で公表
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
研究代表医師
法内整合性
(多)総括報告書の
概要提出時は、計画
書と SAP を添えて
速やかに厚生労働大
臣に提出
(多)実施計画新
規・変更時、軽微変
更時、総括報告書の
概要の大臣提出時は
jRCT で公表を行っ
たものとみなす
(多)研究代表医師
Sponsor(5.22)
Sponsor(3.17)
なし
なし
なし
Sponsor
ICHーGCP に準拠
(多)研究代表医師
規定なし
規定なし
なし
Sponsor(EU CTR)
なし
Sponsor
法内整合性
(多)非特定で jRCT に
主要評価項目報告書・総
括報告書の概要を公表し
た時は速やかに管理者に
報告するとともに、他の
研究責任医師に情報提供
(多)研究代表医師
規定なし
管理者報告なし、
Sponsor は研究責任医
師に要約を提供
(3.17)
なし
なし
なし
Sponsor、研究責任医
師が管理者に報告
法内整合性
(多)総括報告書の
概要提出時に計画書
と SAP を添えて速
やかに厚生労働大臣
に提出した時は速や
かに管理者に報告す
るとともに他の研究
責任医師に情報提供
(多)研究代表医師
規定なし
規定なし
なし
なし
なし
Sponsor、研究責任医
師が管理者に報告
法内整合性
(多)速やかに情報
提供内容を管理者に
報告
(多)他の研究責任
医師
規定なし
規定なし
なし
なし
なし
研究責任医師
法内整合性
研究に用いる医薬品等の
品質の確保のために必要
な措置を講じた上で製造
された医薬品等を用いて
臨床研究を実施
研究責任医師
施設 investigator
(4.6)
製造等 Sponsor
(5.13)
施設 investigator
(2.10)
製造等 Sponsor
(3.15)
Sponsor(312.22)
なし
Sponsor
Regulation2004/103
1)
Sponsor/研究責任医
師
ICHーGCP に準拠
未承認医薬品等を用いる
臨床研究を実施する場合
その他臨床研究の内容に
応じて必要と判断される
場合は、記録を作成又は
入手
研究責任医師
施設 investigator
(4.6)
製造等 Sponsor
(5.14)
施設 investigator
(2.10)
製造等 Sponsor
(3.15)
Sponsor(312.56)
Investigator
(312.61, 312.62)
Sponsor/Investigator
(EU-CTR 56)
Sponsor
Regulation2004/103
1)
Sponsor/研究責任医
師
ICHーGCP に準拠
環境に影響を及ぼすおそ
れのある臨床研究を実施
する場合には、環境へ悪
影響を及ぼさないよう必
要な配慮をしなければな
らない。
研究責任医師
規定なし
規定なし
なし
なし
なし
Sponsor/研究責任医
師
国際規定なし、現行
維持
読
替
臨床研究
に用いる
医薬品等
の品質の
確保等
ICH-E6 (R3)
(作成中)